题目内容
【题目】氮、磷、砷是原子序数依次增大的同一主族的三种元素,其化合物在工业农业中有重要用途。
(1)氮有多种重要的化合物。其中,N2O可用作发泡剂。
①NH3在加热和有催化剂的条件下,可以与O2反应生成N2O,该反应的化学方程式是_________。
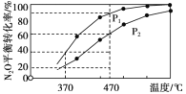
②在体积为1L的密闭容器中充入1mol N2O气体,发生反应2N2O(g) ![]() 2N2(g)+O2(g)。在不同温度下N2O的平衡转化率如下图所示。该反应的△H_________0(填“>”、“<”或“=” ),P1_______P2(填“大于”、“小于”或“等于”),370℃时,该反应的平衡常数K=_________。
2N2(g)+O2(g)。在不同温度下N2O的平衡转化率如下图所示。该反应的△H_________0(填“>”、“<”或“=” ),P1_______P2(填“大于”、“小于”或“等于”),370℃时,该反应的平衡常数K=_________。
(2)PH3和NH3与卤化氢的反应相似,产物的结构与性质也相似,下列对PH3与HCl反应产物的推断正确的是_________(选填字母序号)。
a.能与NaOH溶液反应 b.含有离子键与非极性共价键 c.水溶液显酸性
(3)三价砷有剧毒,五价砷毒性减弱。含As2O3的污水可被次氯酸钠碱性溶液转化为AsO43-而降低毒性。该反应的离子方程式是_________。
(4)HNO3、H3PO4、H3AsO4的酸性由强到弱的关系是________,请用原子结构理论解释原因__________。
【答案】2NH3+2O2![]() N2O+3H2O > 小于 0.089 a c As2O3+2ClO— +6OH—=2AsO43—+2Cl—+3H2O HNO3>H3PO4>HAsO3 N、P、As三种非金属元素位于同主族,最外层电子数相同,随着原子序数逐渐增大,原子半径也逐渐增大,非金属性逐渐减弱,最高价氧化物对应水化物酸性减弱
N2O+3H2O > 小于 0.089 a c As2O3+2ClO— +6OH—=2AsO43—+2Cl—+3H2O HNO3>H3PO4>HAsO3 N、P、As三种非金属元素位于同主族,最外层电子数相同,随着原子序数逐渐增大,原子半径也逐渐增大,非金属性逐渐减弱,最高价氧化物对应水化物酸性减弱
【解析】
(1)①NH3在加热和有催化剂的条件下,与O2反应生成N2O,根据元素守恒,产物还有H2O,据此写出化学方程式;
②升高温度,N2O的转化率增大,平衡正移,结合温度对平衡移动的影响判断△H;温度相同时,P1对应N2O的转化率大,说明P1相对于P2平衡正移,结合该反应为气体体积增大的反应即可得结论;根据已知数据列三段式求解,K=![]() ;
;
(2)NH3+HCl=NH4Cl,产物NH4Cl可与NaOH溶液反应,NH4Cl含有离子键和极性共价键,NH4Cl水解使溶液呈酸性,联系题意寻找答案;
(3)As2O3被次氯酸钠碱性溶液转化为AsO43-,同时结合化合价升降可知,次氯酸钠转化为Cl-,结合电荷守恒书写离子方程式;
(4)同主族元素最外层电子数相同,随着原子序数逐渐增大,原子半径也逐渐增大,非金属性逐渐减弱,最高价氧化物对应水化物酸性减弱。
(1)①NH3在加热和有催化剂的条件下,与O2反应生成N2O,根据元素守恒,产物还有H2O,化学方程式为:2NH3+2O2=N2O+3H2O,故答案为:2NH3+2O2![]() N2O+3H2O;
N2O+3H2O;
②根据图示,升高温度,N2O的转化率增大,平衡正移,说明正反应为吸热反应,△H>0;
温度相同时,P1对应N2O的转化率大,说明P1相对于P2平衡正移,结合该反应为气体体积增大的反应,所以P1<P2;
已知起始量1mol N2O,370℃时,N2O的转化率为40%,则△n(N2O)=1mol×40%=0.4mol,列三段式如下:

平衡常数K=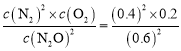 =0.089mol/L;故答案为:>;小于;0.089mol/L;
=0.089mol/L;故答案为:>;小于;0.089mol/L;
(2)由于PH3和NH3与卤化氢的反应相似,产物的结构与性质也相似,而NH3+HCl=NH4Cl,产物NH4Cl可与NaOH溶液反应,NH4Cl含有离子键和极性共价键,NH4Cl水解使溶液呈酸性,故答案为:ac;
(3)As2O3被次氯酸钠碱性溶液转化为AsO43-,同时结合化合价升降可知,次氯酸钠转化为Cl-,结合电荷守恒书写离子方程式为:As2O3+2ClO-+6OH-=2AsO43-+2Cl-+3H2O,故答案为:As2O3+2ClO-+6OH-=2AsO43-+2Cl-+3H2O;
(4)N、P、As三种非金属元素位于同主族,最外层电子数相同,随着原子序数逐渐增大,原子半径也逐渐增大,非金属性逐渐减弱,最高价氧化物对应水化物酸性减弱,所以HNO3、H3PO4、H3AsO4的酸性由强到弱的关系是:HNO3>H3PO4>H3AsO4,故答案为:HNO3>H3PO4>H3AsO4;N、P、As三种非金属元素位于同主族,最外层电子数相同,随着原子序数逐渐增大,原子半径也逐渐增大,非金属性逐渐减弱,最高价氧化物对应水化物酸性减弱。