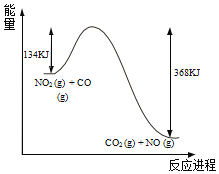
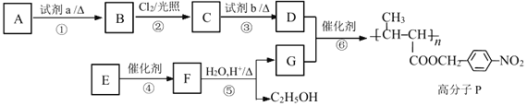
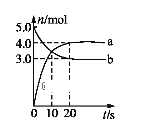
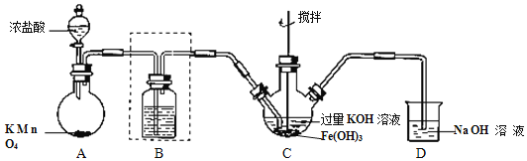
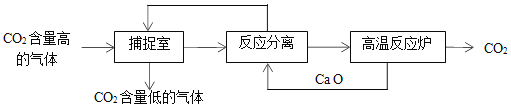
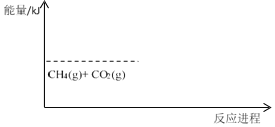
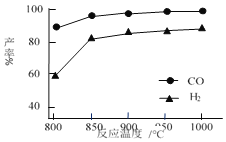
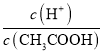0 201523 201531 201537 201541 201547 201549 201553 201559 201561 201567 201573 201577 201579 201583 201589 201591 201597 201601 201603 201607 201609 201613 201615 201617 201618 201619 201621 201622 201623 201625 201627 201631 201633 201637 201639 201643 201649 201651 201657 201661 201663 201667 201673 201679 201681 201687 201691 201693 201699 201703 201709 201717 203614