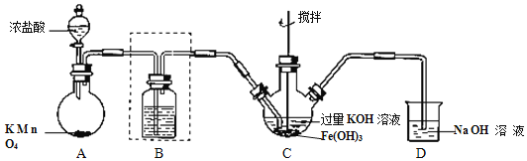
题目内容
【题目】在一固定容积的密闭容器中,可逆反应: H2(g) + I2(g) ![]() 2HI (g)达到平衡的标志是
2HI (g)达到平衡的标志是
A. H2、I2、HI的分子数之比为1∶1∶2
B. 混合气体的密度保持不变
C. 单位时间生成n mol H2,同时消耗2n mol HI
D. 混合气体的颜色不再发生变化
【答案】D
【解析】
A.反应H2(g) + I2(g)![]() 2HI (g)是一个反应前后气体体积相等的反应。当H2、I2、HI的分子数之比为1∶1∶2时反应可能达到平衡,也可能未达到平衡,故不能作为判断平衡的标志。故A错误;
2HI (g)是一个反应前后气体体积相等的反应。当H2、I2、HI的分子数之比为1∶1∶2时反应可能达到平衡,也可能未达到平衡,故不能作为判断平衡的标志。故A错误;
B.容器的容积不变,无论是否反应混合气体的质量不变,所以密度也就保持不变。所以不能作为判断平衡状态的标志。故B错误;
C.在任何时刻,单位时间每生成n mol H2,必同时消耗2n mol HI,这是反应逆向进行时二者计量系数的关系,不能作为判断平衡状态的标志。故C错误;
D.在H2、I2、HI三种分子中只有I2是有颜色的。由于容器的容积固定不变,所以当混合气体的颜色不再发生变化,说明c(I2)不变,反应达到平衡状态。故D正确。
本题选D。

 阅读快车系列答案
阅读快车系列答案【题目】常温下,现有氨水和盐酸两溶液。回答以下问题:
(1)若向氨水中加入少量硫酸铵固体,此时溶液中 ________。(增大、减小、不变)
________。(增大、减小、不变)
(2)若向该氨水中加入氢氧化钠固体,则该电离平衡向_________方向移动(分子化、离子化),电离平衡常数______________。(增大、减小或不变)
(3)0.2 mol/L氨水和0.2 mol/L 盐酸溶液与等体积混合,溶液呈_____性 (酸、碱、中) ;其原因用离子方程式表示为__________________。混合液中,c(NH4+)+c(NH3H2O)=_______mol/L。(忽略体积变化)。请根据电荷守恒写出一个用离子浓度表示的等式_____________________。
(4)用0.1000mol/L HCl溶液滴定未知浓度的NaOH溶液,重复三次的实验数据如下所示
序号 | 0.100mol/L HCl溶液体积/mL | 待测NaOH溶液体积/mL |
1 | 27.83 | 25.00 |
2 | 26.53 | 25.00 |
3 | 27.85 | 25.00 |
该滴定可以使用的指示剂是__________;达到滴定终点时的现象是____________________。
待测NaOH溶液的物质的量浓度为_____________mol/L。(保留四位有效数字)