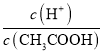题目内容
【题目】一定温度下,在2 L固定容积的密闭容器中发生反应: 2N2O5(g)![]() 4NO2(g) + O2(g)ΔH>0。反应物和部分生成物的物质的量随反应时间变化的曲线如图所示。下列说法中正确的是
4NO2(g) + O2(g)ΔH>0。反应物和部分生成物的物质的量随反应时间变化的曲线如图所示。下列说法中正确的是
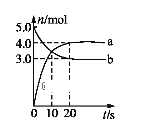
A.曲线a表示NO2的物质的量随反应时间的变化
B.0-20 s内平均反应速率v(N2O5) = 0.1 mol·(L·s)-1
C.10 s时,正、逆反应速率相等,达到平衡
D.20 s时,正反应速率大于逆反应速率
【答案】A
【解析】
A、在反应2N2O5(g)4NO2(g)+O2(g)中N2O5为反应物NO2为生成物,它们的计量数之比为1:2,也就是说NO2增加的物质的量是N2O5减小的物质的量的两倍,结合图中的数据可知曲线a表示NO2的物质的量随反应时间的变化,曲线b表示N2O5的物质的量随反应时间的变化,故A正确;
B、在反应2N2O5(g)4NO2(g)+O2(g)中N2O5为反应物NO2为生成物,它们的计量数之比为1:2,也就是说NO2增加的物质的量是N2O5减小的物质的量的两倍,所以曲线a表示NO2的物质的量随反应时间的变化,曲线b表示N2O5的物质的量随反应时间的变化,根据![]() =0.05 mol(Ls)-1,故B错误;
=0.05 mol(Ls)-1,故B错误;
C、根据图中可知10 s时反应物还在继续减小而生成物还在继续增大,所以此时反应还在正向进行,即正反应速率大于逆反应速率,故C错误;
D、根据图中反应物和生成物的物质的变化情况可知,20 s时有关物质的物质的量不再随时间的变化而变化,即反应处于平衡状态,此时正逆反应速率相等,,故D错误。
故答案为A。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目