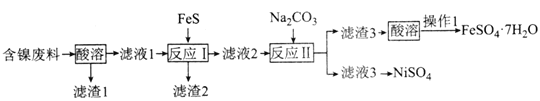
题目内容
【题目】食盐中含有一定量的镁、铁等杂质,加碘盐可能含有 K+、IO3-、I-、Mg2+.加碘盐中碘的损失主要是由于杂质、水分、空气中的氧气以及光照、受热引起的。
已知:IO3-+5I-+6H+→3I2+3H2O,2Fe3++2I-→2Fe2++I2,KI+I2KI3;氧化性: IO3->Fe3+>I2。
(1)学生甲对某加碘盐进行如下实验,以确定该加碘盐中碘元素的存在形式。取一定量加碘盐,用适量蒸馏水溶解,并加稀盐酸酸化,将所得溶液分为 3 份。第一份试液中滴加 KSCN 溶液后显红色;第二份试液中加足量 KI 固体,溶液显淡黄色,加入 CCl4,下层溶液显紫红色;第三份试液中加入适量 KIO3 固体后,滴加淀粉试剂,溶液不变色。
①第一份试液中,加 KSCN 溶液显红色,该红色物质是______(用化学式表示)。
②第二份试液中“加入 CCl4”的实验操作名称为______,CCl4 中显紫红色的物质是______(用化学式表示)。
③根据这三次实验,学生甲得出以下结论:
在加碘盐中,除了 Na+、Cl-以外,一定存在的离子是______,可能存在的离子是______,一定不存在的离子是______。由此可确定,该加碘盐中碘元素是______价(填化合价)的碘。
(2)将 I2溶于 KI 溶液,在低温条件下,可制得 KI3H2O.该物质作为食盐加碘剂是否合适?______(填“是”或“否”),并说明理由______。
(3)已知:I2+2S2O32-→2I-+S4O62-.学生乙用上述反应方程式测定食用精制盐的碘含量(假设不含Fe3+),其步骤为:
a.准确称取 wg 食盐,加适量蒸馏水使其完全溶解;
b.用稀硫酸酸化所得溶液,加入足量 KI 溶液,使 KIO3与 KI 反应完全;
c.以淀粉溶液为指示剂,逐滴加入物质的量浓度为 2.0×10-3mol/L 的 Na2S2O3 溶液 10.0mL,恰好反应完全。
根据以上实验,学生乙所测精制盐的碘含量(以 I 元素计)是______mg/kg(以含w的代数式表示)。
【答案】Fe(SCN)3 萃取 I2 ![]() 和Fe3+ Mg2+、K+ I- +5 否 KI3受热(或潮湿)条件下产生KI和I2,KI被氧气氧化,I2易升华
和Fe3+ Mg2+、K+ I- +5 否 KI3受热(或潮湿)条件下产生KI和I2,KI被氧气氧化,I2易升华 ![]()
【解析】
(1)①从第一份试液中滴加KSCN溶液后显红色,可知该加碘盐中含有Fe3+,反应:Fe3++3SCN-=Fe(SCN)3,Fe(SCN)3呈血红色;
②从第二份试液中加足量KI固体,溶液显淡黄色,用CCl4萃取,下层溶液显紫红色,可知有碘生成。
③这是因为由于氧化性:![]() >Fe3+>I2,加足量KI后,
>Fe3+>I2,加足量KI后,![]() 和Fe3+均能将I-氧化成I2,由此也可以知道该加碘盐添加KIO3,根据化合价规律确定该加碘盐中碘元素的价态;第三份试液中加入适量KIO3固体后,滴加淀粉试剂,溶液不变色。由此可知该加碘盐中不含KI;
和Fe3+均能将I-氧化成I2,由此也可以知道该加碘盐添加KIO3,根据化合价规律确定该加碘盐中碘元素的价态;第三份试液中加入适量KIO3固体后,滴加淀粉试剂,溶液不变色。由此可知该加碘盐中不含KI;
③具有氧化性的离子为![]() 与具有还原性的离子为I-,发生氧化还原反应;
与具有还原性的离子为I-,发生氧化还原反应;
(2)根据KI具有还原性及氧化还原反应、KI3在常温下不稳定性来分析;
(3)存在KIO3~3I2~6Na2S2O3,以此计算含碘量。
(1)①某加碘盐可能含有K+、![]() 、I-、Mg2+,用蒸馏水溶解,并加稀盐酸酸化后将溶液分为3份:从第一份试液中滴加KSCN溶液后显红色,可知该加碘盐中含有Fe3+,反应:Fe3++3SCN-=Fe(SCN)3,Fe(SCN)3呈血红色;
、I-、Mg2+,用蒸馏水溶解,并加稀盐酸酸化后将溶液分为3份:从第一份试液中滴加KSCN溶液后显红色,可知该加碘盐中含有Fe3+,反应:Fe3++3SCN-=Fe(SCN)3,Fe(SCN)3呈血红色;
故答案为:Fe(SCN)3;
②从第二份试液中加足量KI固体,溶液显淡黄色,用CCl4萃取,下层溶液显紫红色,可知有碘生成,
故答案为:萃取;I2;
③据上述实验得出氧化性:![]() >Fe3+>I2,加足量KI后,IO3-和Fe3+均能将I-氧化成I2,由此也可以知道该加碘盐添加KIO3,该加碘盐中碘元素是+5价;第三份试液中加入适量KIO3固体后,滴加淀粉试剂,溶液不变色。由此可知该加碘盐中不含KI,一定存在的离子是:IO3-和Fe3+,可能存在的离子是:Mg2+、K+,一定不存在的离子是I-,
>Fe3+>I2,加足量KI后,IO3-和Fe3+均能将I-氧化成I2,由此也可以知道该加碘盐添加KIO3,该加碘盐中碘元素是+5价;第三份试液中加入适量KIO3固体后,滴加淀粉试剂,溶液不变色。由此可知该加碘盐中不含KI,一定存在的离子是:IO3-和Fe3+,可能存在的离子是:Mg2+、K+,一定不存在的离子是I-,
故答案为:![]() 和Fe3+;Mg2+、K+;I-;+5;
和Fe3+;Mg2+、K+;I-;+5;
(2)KI作为加碘剂的食盐在保存过程中,KI会被空气中氧气氧化,根据题目告知,KI3H2O是在低温条件下,由I2溶于KI溶液可制得,再由题给的信息:“KI+I2KI3”,可知KI3在常温下不稳定性,受热(或潮湿)条件下易分解为KI和I2,KI又易被空气中的氧气氧化,I2易升华,所以KI3H2O作为食盐加碘剂是不合适的,
故答案为:否;KI3受热(或潮湿)条件下产生KI和I2,KI被氧气氧化,I2易升华;
(3)根据反应式可知,设所测精制盐的碘含量(以I元素计)是xmg/kg,则

因此所测精制盐的碘含量是x=![]() =
=,
故答案为:![]() 。
。

 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案【题目】实验室常用亚硫酸钠固体和70%的浓硫酸制备SO2气体,反应方程式为Na2SO3+H2SO4=Na2SO4+SO2↑+H2O,请设计一套实验装置,收集一试管干燥的SO2气体。
(1)在下面方框中,A表示由分液漏斗和锥形瓶组成的气体发生器,请在答题卡上的A后完成该反应的实验装置示意图(夹持装置、连接胶管不必画出,尾气处理部分必须画出,需要加热的仪器下方用△标出),按气流方向在每件仪器下方标出字母B、C…;其它可选用的仪器(数量不限)简易表示如下:___

(2)根据方框中的装置图甲,在答题卡上填写下表(可不填满)___
仪器标号 | 仪器中所加物质 | 作用 |
A | 亚硫酸钠、浓硫酸 | 产生SO2 |
(3)某实验小组用如图乙装置测定收集到的气体中SO2的含量,反应管中装有酸性高猛酸钾溶液。
①SO2和酸性高猛酸钾溶液发生反应的离子方程式为:___。
②反应管内溶液紫红色消失后,若没有及时停止通气,则测得的SO2含量___(选填:“偏高”、“偏低”或“无影响”)
③若酸性高猛酸钾溶液体积为V1mL,浓度为cmol/L,量气管内增加的水的体积为V2mL(已折算成标准状况下的体积)。用c、V1、V2表示SO2的体积百分含量为___。
【题目】以菱锰矿![]() 主要成分
主要成分![]() ,还含有
,还含有![]() 、
、![]() 等杂质
等杂质![]() 为原料制备二氧化锰的工艺流程如下:
为原料制备二氧化锰的工艺流程如下:
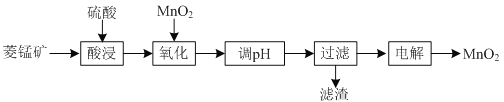
已知部分金属离子开始沉淀及沉淀完全时的pH如下表所示:
金属离子 |
|
|
|
|
开始沉淀时的pH |
|
|
|
|
沉淀完全时的pH |
|
|
|
|
(1)①“酸浸”时![]() 发生反应的离子方程式为________________________________________。
发生反应的离子方程式为________________________________________。
②“酸浸”过程中加入过量硫酸的目的除了加快酸浸的速率、_____________、___________。
③要提高“酸浸”的速率,还可以采取的方法是________________________________________。
(2)“氧化”时发生反应的离子方程式为________________________________________。
(3)“调pH”的目的是除去溶液中的杂质金属离子,“调pH”的范围应为_______________。
(4)当溶液中c(Al3+)≤10-5mol/L时,则认为![]() 沉淀完全,则
沉淀完全,则![]() ______________。
______________。