题目内容
【题目】某研究性学习小组制备高铁酸钾(K2FeO4)并探究其性质。查阅文献,得到以下资料: K2FeO4为紫色固体,微溶于 KOH 溶液;具有强氧化性,在酸性或中性溶液中快速产生 O2,在碱性溶液中较稳定。
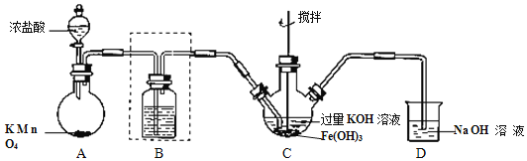
Ⅰ.制备 K2FeO4(夹持装置略)。
(1)A 为氯气的实验室发生装置。A 中反应方程式是______(锰被还原为 Mn2+)。若反应中有 0.5molCl2产生,则电子转移的数目为______。工业制氯气的反应方程式为______。
(2)装置 B 中盛放的试剂是______,简述该装置在制备高铁酸钾中的作用______。
(3)C 中得到紫色固体和溶液。C 中 Cl2发生的反应有:3Cl2+2Fe(OH)3+10KOH→2K2FeO4+6KCl+8H2O,根据该反应方程式得出:碱性条件下,氧化性 Cl2______FeO42-(填“>”或“<”)。另外C中还可能发生其他反应,请用离子方程式表示______。
Ⅱ.探究 K2FeO4 的性质
(4)甲同学取少量 K2FeO4 加入浑浊的泥浆水中,发现产生气体,搅拌,浑浊的泥浆水很快澄清。请简述 K2FeO4的净水原理。______。
【答案】2KMnO4+16HCl(浓)=2MnCl2+2KCl+5Cl2↑+8H2O NA 2NaCl+2H2O![]() 2NaOH+Cl2↑+H2↑ 饱和食盐水 除去HCl气体,避免影响K2FeO4的制备 > Cl2+2OH-=Cl-+ClO-+H2O K2FeO4在中性溶液中快速产生氧气,生成氢氧化铁吸附泥浆,沉降下来,达到净水的目的
2NaOH+Cl2↑+H2↑ 饱和食盐水 除去HCl气体,避免影响K2FeO4的制备 > Cl2+2OH-=Cl-+ClO-+H2O K2FeO4在中性溶液中快速产生氧气,生成氢氧化铁吸附泥浆,沉降下来,达到净水的目的
【解析】
由制备实验装置可知,A中发生2KMnO4+16HCl(浓)=2MnCl2+2KCl+5Cl2↑+8H2O,B中饱和食盐水除去氯气中的HCl,C中发生3Cl2+2Fe(OH)3+10KOH=2K2FeO4+6KCl+8H2O,且C中可能发生Cl2+2OH-=Cl-+ClO-+H2O,D中NaOH溶液可吸收尾气,以此来解答。
(1)A中反应方程式是2KMnO4+16HCl(浓)=2MnCl2+2KCl+5Cl2↑+8H2O,若反应中有0.5molCl2产生,则电子转移的数目为0.5mol×2×(1-0)×NA=NA,工业制氯气的反应方程式为2NaCl+2H2O![]() 2NaOH+Cl2↑+H2↑,
2NaOH+Cl2↑+H2↑,
故答案为:2KMnO4+16HCl(浓)=2MnCl2+2KCl+5Cl2↑+8H2O;NA;2NaCl+2H2O![]() 2NaOH+Cl2↑+H2↑;
2NaOH+Cl2↑+H2↑;
(2)装置B中盛放的试剂是饱和食盐水,该装置在制备高铁酸钾中的作用为除去HCl气体,避免影响K2FeO4的制备,
故答案为:饱和食盐水;除去HCl气体,避免影响K2FeO4的制备;
(3)Cl元素的化合价降低,Fe元素的化合价升高,由氧化剂的氧化性大于氧化产物的氧化性可知碱性条件下,氧化性Cl2>FeO42-,C中还可能发生氯气与KOH反应,用离子方程式表示为:Cl2+2OH-=Cl-+ClO-+H2O,
故答案为:>;Cl2+2OH-=Cl-+ClO-+H2O;
(4)取少量K2FeO4加入浑浊的泥浆水中,发现产生气体,搅拌,浑浊的泥浆水很快澄清,可知K2FeO4的净水原理为K2FeO4在中性溶液中快速产生氧气,生成氢氧化铁吸附泥浆,沉降下来,达到净水的目的,
故答案为:K2FeO4在中性溶液中快速产生氧气,生成氢氧化铁吸附泥浆,沉降下来,达到净水的目的。

 阅读快车系列答案
阅读快车系列答案【题目】海洋资源的开发与利用具有广阔的前景。海水的pH一般在7.5~8.6之间。某地海水中主要离子的含量如下表:
成分 | Na+ | K+ | Ca2+ | Mg2+ | Cl- | SO42- | HCO3- |
含量/mgL-1 | 9360 | 83 | 160 | 1100 | 16000 | 1200 | 118 |
(1)海水显弱碱性的原因是(用离子方程式表示):____________,该海水中Ca2+的物质的量浓度为__________mol/L 。
(2)电渗析法是近年发展起来的一种较好的海水淡化技术,其原理如下图所示。其中阴(阳)离子交换膜只允许阴(阳)离子通过,电极均为惰性电极。

① 开始时阳极的电极反应式为________________。
② 电解一段时间,____极(填“阴”或“阳”)会产生水垢,其成份为_____(填化学式)。
③ 淡水的出口为a、b、c中的__________出口。
(3)海水中锂元素储量非常丰富,从海水中提取锂的研究极具潜力。锂是制造化学电源的重要原料,如LiFePO4电池某电极的工作原理如图所示:

该电池电解质为能传导 Li+的固体材料。
上面左图中的小黑点表示_____(填粒子符号),充电时该电极反应式为_______。
(4)利用海洋资源可获得MnO2 。MnO2可用来制备高锰酸钾:将MnO2与KOH混合后在空气中加热熔融,得到绿色的锰酸钾(K2MnO4),再利用氯气将锰酸钾氧化成高锰酸钾。该制备过程中消耗相同条件下氯气和空气的体积比为_________(空气中氧气的体积分数按20%计)。


