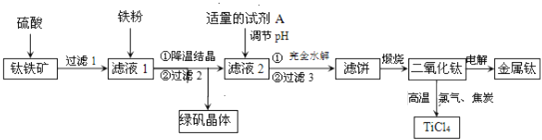
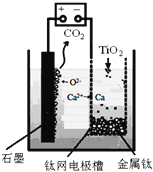
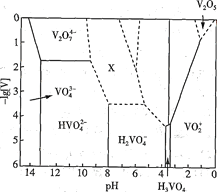
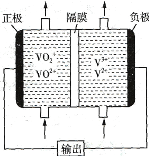
【题目】将0.4mol N2气体和1mol H2气体在2L固定的容器内混合,在一定条件下发生反应:N2(g)+3H2(g)2NH3(g),若2min后测得NH3的浓度为0.2molL-1,
(1)2min时H2的转化率为______。
(2)2min时三种气体的总量为_____mol。
(3)相同温度下,若2min后该反应达平衡,则反应前后的气体压强比为___ 。
(4)下列措施能增大反应速率的是___(填字母)。
A.恒温恒容充入He气 B.缩小体积,使压强增大
C.恒温恒压充入He气 D.使用催化剂
(5)从化学键的角度分析,化学反应的过程就是反应物的化学键的破坏和生成物的化学键的形成过程。已知:1molN2和3molH2反应生成2molNH3时放出热量93kJ:
化学键 | H-H | N-H | N≡N |
键能kJ/rmol | 436 | a | 945 |
试根据表中所列键能数据计算a的数值______。
【题目】25℃时,部分物质的电离平衡常数如表所示:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | 1.7×10﹣4molL﹣1 | K1=4.4×10﹣6molL﹣1 K2=5.6×10﹣11molL﹣1 | 3.0×10﹣8 molL﹣1 |
请回答下列问题:
(1)同浓度的CH3COOH、H2CO3、HClO溶液的pH最大的是_____.
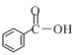
(2)常温下0.1molL﹣1的CH3COOH溶液在加水稀释过程中,下列表达式的数据一定变小的是_____(填字母序号,下同).
A.c(H+)
B.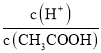
C.c(H+)c(OH﹣)
D.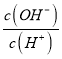
E.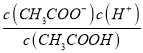
若该溶液升高温度,上述5种表达式的数据增大的是_________.
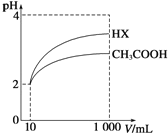
(3)体积为10mL pH=2的醋酸溶液与一元酸HX溶液分别加水稀释至1000mL,稀释过程pH变化如图:则HX的电离平衡常数_____(填“大于”、“等于”或“小于”)醋酸的平衡常数.稀释后,HX溶液中有水电离出来的c(H+)_____(填“大于”、“等于”或“小于”)醋酸的溶液中有水电离出来的c(H+),理由是___________.
(4)已知100℃时,水的离子积为1×10﹣12,该温度下测得某溶液PH=7,该溶液显_____(填“酸”、“碱”或“中”)性.将此温度下PH=1的H2SO4溶液aL与PH=11的NaOH溶液bL混合,若所得混合液PH=2,则a:b=_____.