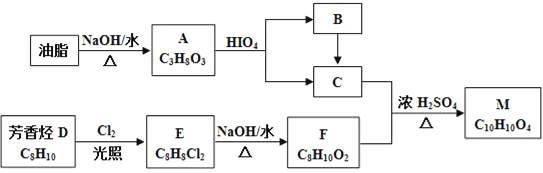
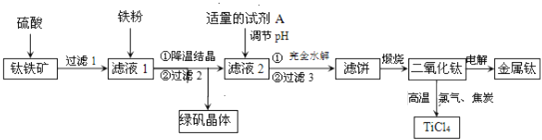
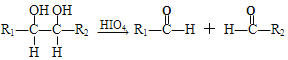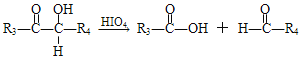题目内容
【题目】将0.4mol N2气体和1mol H2气体在2L固定的容器内混合,在一定条件下发生反应:N2(g)+3H2(g)2NH3(g),若2min后测得NH3的浓度为0.2molL-1,
(1)2min时H2的转化率为______。
(2)2min时三种气体的总量为_____mol。
(3)相同温度下,若2min后该反应达平衡,则反应前后的气体压强比为___ 。
(4)下列措施能增大反应速率的是___(填字母)。
A.恒温恒容充入He气 B.缩小体积,使压强增大
C.恒温恒压充入He气 D.使用催化剂
(5)从化学键的角度分析,化学反应的过程就是反应物的化学键的破坏和生成物的化学键的形成过程。已知:1molN2和3molH2反应生成2molNH3时放出热量93kJ:
化学键 | H-H | N-H | N≡N |
键能kJ/rmol | 436 | a | 945 |
试根据表中所列键能数据计算a的数值______。
【答案】60% 1 7:5 BD 391
【解析】
根据“三段式”计算出转化率,min时三种气体的总量,反应前后的气体压强比;根据化学反应速率的影响因素分析;根据焓变的计算公式进行计算。
(1)将0.4mol N2气体和1mol H2气体在2L固定的容器内混合,发生化学反应,2min后测得NH3的浓度为0.2molL-1,体积为2L,故氨气的物质的量为cV=0.2molL-1×2L=0.4mol,列出“三段式”,

(1)2min时H2的转化率为变化的物质的量浓度与起始物质的量浓度之比,由于体积相同,转化率为变化的物质的量与起始物质的量之比为![]() =60%;
=60%;
(2)2min时三种气体的总量为0.2mol+0.4mol+0.4mol=1mol;
(3)相同温度下,若2min后该反应达平衡,则反应前后的气体压强比为物质的量之比,为![]() =
=![]() =7:5;
=7:5;
(4) A.恒温恒容充入He气,气体的分压不变,故反应速率不变,故A不符合题意;
B.缩小体积,使压强增大,气体的浓度增大,反应速率加快,故B符合题意;
C.恒温恒压充入He气,气体的浓度减小,反应速率减慢,故C不符合题意;
D.使用催化剂,降低反应的活化能,反应速率加快,故D符合题意;
可以加快反应速率的有BD;
(4) 1molN2和3molH2反应生成2molNH3时放出热量93kJ,反应的焓变为反应物断裂化学键吸收的总能量-形成化学键吸收的总能量,436kJ/rmol×3+945kJ/rmol-6akJ/rmol=-93kJ/rmol,解得a=391kJ/rmol。

 阅读快车系列答案
阅读快车系列答案