题目内容
【题目】钒的化合物常用于制催化剂和新型电池。回答下列问题:
(1) V2O5为黄褐色固体,无味、有毒,微溶于水,是许多反应的催化剂。25℃时,部分含钒微粒的存在形式、浓度及存在的pH范围之间的变化关系如图所示(其余可溶性微粒均未标出),图中“[V]”表示含钒微粒的浓度,虚线表示[V]或pH的范围尚未确定。
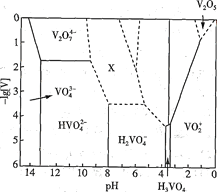
①V2O5溶于足量1.0 mol·L-1NaOH溶液中,发生反应的离子方程式为_____________________
②上述滴加H2SO4溶液的过程中,先后发生如下反应:

则“X所示区域的离子”不可能是____________(填标号)。
A.V3O93- B.V4 O103- C.V4 O124-
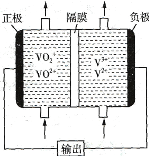
(2)如图所示为可充电的全钒液流电池构造示意图,该电池中的隔膜只允许H+通过。电池放电时,负极区溶液的pH将_________ (填“增大”“减小”或“不变”),电池充电时,阳极的电极反应式为_______________________________________。
【答案】V2O5+6OH-=2VO43-+3H2O B 增大 VO2+-e-+H2O=VO2++2H+
【解析】
(1)①V2O5溶于足量1.0 mol·L-1NaOH溶液中生成Na3VO4和水;
②上述滴加硫酸溶液的过程中,先后发生题干的反应,结合图象中微粒存在的pH进行分析判断;
(2)钒液流电池放电时负极的发生氧化反应,正极发生还原反应,充电时,阳极发生氧化反应;
(1)①由图可知碱性条件下,以VO43-形式存在,因此V2O5溶于足量1.0 mol·L-1NaOH溶液中,生成Na3VO4和水,反应的离子方程式为:V2O5+6OH-=2VO43-+3H2O;
②上述滴加硫酸溶液的过程中,先后发生题干的反应,H2VO4-缩合后,V的化合价不变,则“X所示区域的离子”不可能是V4 O103-,答案选B;
(2)钒液流电池放电时负极的发生氧化反应,电极反应为:V2+-e-=V3+,H+向正极移动,正极发生还原反应,负极区溶液pH增大,充电时,阳极发生氧化反应,电极反应为VO2+-e-+H2O=VO2++2H+。

 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案 激活思维优加课堂系列答案
激活思维优加课堂系列答案【题目】25℃时,部分物质的电离平衡常数如表所示:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | 1.7×10﹣4molL﹣1 | K1=4.4×10﹣6molL﹣1 K2=5.6×10﹣11molL﹣1 | 3.0×10﹣8 molL﹣1 |
请回答下列问题:
(1)同浓度的CH3COOH、H2CO3、HClO溶液的pH最大的是_____.
(2)常温下0.1molL﹣1的CH3COOH溶液在加水稀释过程中,下列表达式的数据一定变小的是_____(填字母序号,下同).
A.c(H+)
B.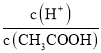
C.c(H+)c(OH﹣)
D.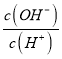
E.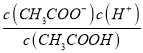
若该溶液升高温度,上述5种表达式的数据增大的是_________.
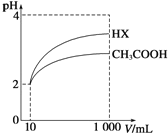
(3)体积为10mL pH=2的醋酸溶液与一元酸HX溶液分别加水稀释至1000mL,稀释过程pH变化如图:则HX的电离平衡常数_____(填“大于”、“等于”或“小于”)醋酸的平衡常数.稀释后,HX溶液中有水电离出来的c(H+)_____(填“大于”、“等于”或“小于”)醋酸的溶液中有水电离出来的c(H+),理由是___________.
(4)已知100℃时,水的离子积为1×10﹣12,该温度下测得某溶液PH=7,该溶液显_____(填“酸”、“碱”或“中”)性.将此温度下PH=1的H2SO4溶液aL与PH=11的NaOH溶液bL混合,若所得混合液PH=2,则a:b=_____.
【题目】某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的氢氧化钠溶液,请填写下列空白:
(1)选用的指示剂是______________________。
(2)用标准的盐酸溶液滴定待测的氢氧化钠溶液时,左手把握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视______________________。
(3)下列操作中可能使所测氢氧化钠溶液的浓度数值偏低的是_______________。
A.酸式滴定管未用标准盐酸溶液润洗就直接注入标准盐酸溶液
B.滴定前盛放氢氧化钠溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
(4)若滴定开始和结束时,酸式滴定管中的液面如图所示,请将数据填入下面表格的横线处。
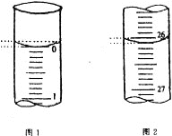
滴定次数 | 待测氢氧化钠溶液的体积/ mL | 0.1000 mol/L 盐酸的体积/ mL | ||
滴定前刻度 | 滴定后刻度 | 溶液体积/ mL | ||
第一次 | 25.00 | 0.00 | ________ | _______ |
第二次 | 25.00 | 2.00 | 28.08 | 26.08 |
第三次 | 25.00 | 0.22 | 26.34 | 26.12 |
(5)请根据上表中数据列式计算该氢氧化钠溶液的物质的量浓度:c(NaOH)= _________。
(6)滴定终点的判定依据是_______________。


