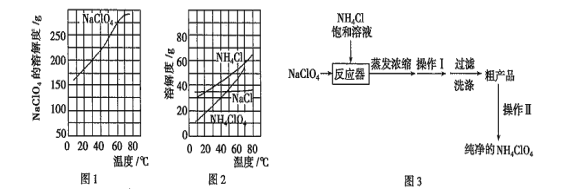
题目内容
【题目】有机化合物在我们的生产生活当中有着重要的作用,探究有机物结构有助于对物质的性质进行研究。
(1)a.![]() b.
b.![]() c.
c.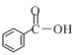
①上述三种物质中b,c中官能团名称分别是__________,__________。
②三种物质在一定条件分别与氢气发生加成反应,同温同压下消耗氢气量关系为______(填“相同”或“不相同”)。
(2)欲区分乙醛和乙酸,应选用 ____(填字母)。
a.NaOH溶液 b.HCl溶液 c.银氨溶液 d.新制氢氧化铜悬浊液
(3)工业上或实验室提纯以下物质的方法不合理的是(括号内为杂质)______。
A. 溴苯(溴):加NaOH溶液,分液 B. 乙烷(乙烯):通入溴水,洗气
C. 乙酸(水):加新制生石灰,蒸馏 D. 乙酸乙酯(乙酸):氢氧化钠溶液,分液
(4)苹果酸(![]() )与NaOH溶液反应的化学方程式___________。
)与NaOH溶液反应的化学方程式___________。
(5)以KOH为电解质的甲醇燃料电池总反应为2CH3OH+3O2+4KOH=2K2CO3+6H2O。电池放电时电解质溶液中OH-向_______(填“正”或“负”)极移动,负极反应式为_______。
【答案】羟基 羧基 相同 cd CD ![]() +2NaOH
+2NaOH![]()
![]() +2H2O 负极 CH3OH+8OH--6e-=
+2H2O 负极 CH3OH+8OH--6e-=![]() +6H2O
+6H2O
【解析】
根据官能团的不同计算出与氢气加成消耗的氢气的物质的量;根据乙醛和乙酸的性质区分;根据除杂要将气体反应掉,不消耗原物质进行分析;根据苹果酸的官能团为羧基,判断与氢氧化钠反应的原理;根据甲醇燃料电池的原理回答。
①上述三种物质中分别含有酚羟基,醇羟基,羧基,b,c中官能团名称分别是羟基、羧基;
②三种物质在一定条件分别与氢气发生加成反应,只有苯环可以与氢气发生加成反应,同温同压下消耗氢气都是3mol,消耗氢气的物质的量相同;
(2) a.乙醛含有醛基,加入NaOH溶液 ,不发生反应,乙酸含有羧基,可以和氢氧化钠溶液反应,但没有明显现象,故不能区分;
b.乙醛和HCl溶液不反应,乙酸和HCl溶液不反应,故不能区分;
c.乙醛能和银氨溶液反应生成银镜,乙酸和银氨溶液混合没有现象,现象不同,可以区分;
d.乙醛能将新制氢氧化铜悬浊液还原为红色的氧化亚铜,乙酸与新制氢氧化铜悬浊液发生酸碱中和反应,蓝色沉淀消失,溶液变为蓝色,现象不同,故可以区分;
答案选cd;
(3) A.溴苯中有溴,加NaOH溶液,NaOH溶液和溴发生反应,溴苯在下层,再分液即可,故A不符合题意;
B.乙烷中有乙烯,通入溴水,乙烯与溴发生加成反应得到1,2-二溴乙烷,乙烷不反应,洗气,可以除杂,故B不符合题意;
C.乙酸中有水,加新制生石灰,蒸馏,乙酸会和生石灰反应,不能蒸馏出,错误,故C符合题意;
D.乙酸乙酯中有乙酸,加氢氧化钠溶液,会使乙酸乙酯水解,乙酸与氢氧化钠发生中和反应,不能用氢氧化钠溶液除杂,应用饱和碳酸钠溶液,故D符合题意;
答案选CD;
(4)1mol苹果酸(![]() )含有2mol羧基,消耗2molNaOH溶液发生酸碱中和反应,化学方程式为:
)含有2mol羧基,消耗2molNaOH溶液发生酸碱中和反应,化学方程式为:![]() +2NaOH
+2NaOH![]()
![]() +2H2O;
+2H2O;
(5)以KOH为电解质的甲醇燃料电池总反应为2CH3OH+3O2+4KOH=2K2CO3+6H2O。电池放电时电解质溶液中阴离子移向负极,OH-向负极移动,甲醇在负极上发生氧化反应,碱性条件下转化为碳酸根,反应的化学方程式为CH3OH+8OH--6e-=![]() +6H2O。
+6H2O。

【题目】影响化学反应速率的因素很多,某校化学小组用实验的方法进行探究。
实验一:他们只利用Cu、Fe、Mg和不同浓度的硫酸(0.5 mol·L-1、2 mol·L-1、18.4 mol·L-1)设计实验方案来研究影响化学反应速率的因素。甲同学的实验报告如下表:
实验步骤 | 现象 | 结论 |
①分别取等体积的2 mol·L-1的硫酸于试管中 | 反应速率Mg>Fe,Cu不反应 | 金属的性质越活泼,反应速率越快 |
②____________ | 反应物浓度越大,反应速率越快 |
(1)甲同学表中实验步骤②为_________________________________________。
(2)甲同学的实验目的是_____________;要得出正确的实验结论,还需控制的实验条件是____________。乙同学为了更精确地研究浓度对反应速率的影响,利用如图所示装置进行定量实验。

(3)乙同学在实验中应该测定的数据是___________________________________________________。
(4)乙同学完成该实验应选用的实验药品是________,该实验中不选用某浓度的硫酸,理由是___________。
实验二:已知 2KMnO4+5H2C2O4+3H2SO4===K2SO4+2MnSO4+8H2O+10CO2↑,在高锰酸钾酸性溶液和草酸溶液反应时,发现开始一段时间,反应速率较慢,溶液褪色不明显;但不久突然褪色,反应速率明显加快。
(5)针对上述实验现象,丙同学认为KMnO4与H2C2O4反应放热,导致溶液温度升高,反应速率加快。从影响化学反应速率的因素看,你猜想还可能是______________的影响。
(6)若用实验证明你的猜想,除高锰酸钾酸性溶液、草酸溶液外,还需要选择的试剂最合理的是________(填字母)。
A.硫酸钾 B.硫酸锰 C.二氯化锰 D.水