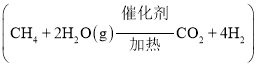题目内容
【题目】二氧化钛是制取航天航空工业钛合金的重要原料.用钛铁矿![]() 主要成分是钛酸亚铁
主要成分是钛酸亚铁![]() ,含少量
,含少量![]() 、MgO、
、MgO、![]() 等杂质
等杂质![]() 作原料生产金属钛和绿矾
作原料生产金属钛和绿矾![]() 等产品的一种工艺流程如下:已知:Ti有两种价态,在水溶液中主要以
等产品的一种工艺流程如下:已知:Ti有两种价态,在水溶液中主要以![]() 无色
无色![]() 、
、![]() 紫色
紫色![]() 形式存在.
形式存在.

请回答下列问题:
![]() 硫酸与
硫酸与![]() 反应生成
反应生成![]() 的化学方程式是______.
的化学方程式是______.
![]() 滤液1中加入适量铁粉,至刚好出现紫色为止,此时溶液仍呈强酸性.
滤液1中加入适量铁粉,至刚好出现紫色为止,此时溶液仍呈强酸性.
已知:氧化性:![]() 则加入铁粉的作用是______.
则加入铁粉的作用是______.
![]() 滤液2中加入适量的试剂A,可选用______
滤液2中加入适量的试剂A,可选用______![]() 填编号
填编号![]() .
.
![]() 稀
稀![]() 通入
通入![]() 鼓入空气
鼓入空气
![]() 已知
已知![]() ,101kPa时,由二氧化钛制取四氯化钛所涉及的反应有:
,101kPa时,由二氧化钛制取四氯化钛所涉及的反应有:
![]() ,
,
![]() ,
,
![]()
反应![]() ______.
______.
![]() 用石墨作阳极、钛网作阴极、熔融
用石墨作阳极、钛网作阴极、熔融![]() 作电解质,利用如图所示装置获得金属钙,并以钙为还原剂还原二氧化钛制备金属钛.写出阴极区反应的电极总反应式是______.
作电解质,利用如图所示装置获得金属钙,并以钙为还原剂还原二氧化钛制备金属钛.写出阴极区反应的电极总反应式是______.

![]() 假如
假如![]() 中的铁元素占矿物中铁元素总量的
中的铁元素占矿物中铁元素总量的![]() ;某次生产中,向滤液1中加入纯铁粉为bkg,得到绿矾晶体的质量为cKg,整个过程中铁元素的总利用率为
;某次生产中,向滤液1中加入纯铁粉为bkg,得到绿矾晶体的质量为cKg,整个过程中铁元素的总利用率为![]() ,Ti元素的转化率为
,Ti元素的转化率为![]() ,其他损失忽略不计.按上述流程,得到
,其他损失忽略不计.按上述流程,得到![]() ______
______![]() 用数字和字母表示
用数字和字母表示![]() 已知:
已知:![]()
【答案】![]() ; 使
; 使![]() 完全还原为
完全还原为![]() ;同时避免过量的铁将
;同时避免过量的铁将![]() 还原成
还原成![]() ,影响产品的纯度;
,影响产品的纯度; ![]() ;
; ![]() ;
; ![]() ;
; ![]()
【解析】
钛铁矿![]() 主要成分
主要成分![]() ,含
,含![]() 、
、![]() 等杂质
等杂质![]() 加入硫酸加热反应得到固体熔块,加入水水浸,得到浸取液中加入铁屑将Fe3+还原为Fe2+,过滤得到X晶体为绿矾
加入硫酸加热反应得到固体熔块,加入水水浸,得到浸取液中加入铁屑将Fe3+还原为Fe2+,过滤得到X晶体为绿矾![]() 晶体和滤液
晶体和滤液![]() ,加入水反应生成
,加入水反应生成![]() ,高温煅烧得到二氧化钛。
,高温煅烧得到二氧化钛。
![]() 钛铁矿主要成分
钛铁矿主要成分![]() ,与硫酸反应的主要产物是
,与硫酸反应的主要产物是![]() 和
和![]() ,结合原子守恒配平书写化学方程式。
,结合原子守恒配平书写化学方程式。
![]() 加入铁屑至浸出液显紫色,说明浸出液中含有
加入铁屑至浸出液显紫色,说明浸出液中含有![]() ,加入铁屑作还原剂,将
,加入铁屑作还原剂,将![]() 还原为
还原为![]() ,同时防止
,同时防止![]() 被
被![]() 氧化。
氧化。
![]() 富含
富含![]() 溶液,加入
溶液,加入![]() 粉末与
粉末与![]() 反应,降低了溶液中
反应,降低了溶液中![]() ,促进TiO2+水解。
,促进TiO2+水解。
![]() 由
由![]() 得反应
得反应![]() 。
。
![]() 电解时,阴极TiO2发生还原反应生成Ti。
电解时,阴极TiO2发生还原反应生成Ti。
![]() 由
由![]() 中铁与钛的关系的钛的含量为:
中铁与钛的关系的钛的含量为:![]() 。
。
利用绿矾的质量,先求出Fe元素的总量,去掉加入铁粉的质量,即可得到![]() 中铁的质量,再利用化学式中Fe、Ti的质量关系,便可求出Ti的质量,从而求出TiO2的质量。
中铁的质量,再利用化学式中Fe、Ti的质量关系,便可求出Ti的质量,从而求出TiO2的质量。
钛铁矿![]() 主要成分
主要成分![]() ,含
,含![]() 、
、![]() 等杂质
等杂质![]() 加入硫酸加热反应得到固体熔块,加入水水浸,得到浸取液中加入铁屑将Fe3+还原为Fe2+,过滤得到X晶体为绿矾
加入硫酸加热反应得到固体熔块,加入水水浸,得到浸取液中加入铁屑将Fe3+还原为Fe2+,过滤得到X晶体为绿矾![]() 晶体和滤液
晶体和滤液![]() ,加入水反应生成
,加入水反应生成![]() ,高温煅烧得到二氧化钛。
,高温煅烧得到二氧化钛。
![]() 钛铁矿主要成分
钛铁矿主要成分![]() 与硫酸反应的主要产物是
与硫酸反应的主要产物是![]() 和
和![]() ,结合原子守恒配平书写化学方程式为:
,结合原子守恒配平书写化学方程式为:![]() 。答案为:
。答案为:![]() ;
;
![]() 加入铁屑至浸出液显紫色,说明浸出液中含有
加入铁屑至浸出液显紫色,说明浸出液中含有![]() ,加入铁屑作还原剂,将
,加入铁屑作还原剂,将![]() 还原为
还原为![]() ,防止
,防止![]() 被
被![]() 氧化成
氧化成![]() 。答案为:使
。答案为:使![]() 完全还原为
完全还原为![]() ;同时避免过量的铁将
;同时避免过量的铁将![]() 还原成
还原成![]() ,影响产品的纯度;
,影响产品的纯度;
![]() 富含
富含![]() 溶液,加入
溶液,加入![]() 粉末与
粉末与![]() 反应,降低了溶液中
反应,降低了溶液中![]() ,使平衡
,使平衡![]() 向生成
向生成![]() 的方向移动,可得到
的方向移动,可得到![]() 粗产品。答案为:b;
粗产品。答案为:b;
![]() 由
由![]() 得:
得:![]() 。答案为:
。答案为:![]() ;
;
![]() 电解时,阴极发生还原反应生成Ti,电极方程式为
电解时,阴极发生还原反应生成Ti,电极方程式为![]() 。答案为:
。答案为:![]() ;
;
![]() 由
由![]() 中铁与钛的关系的钛的含量为:
中铁与钛的关系的钛的含量为:![]() 。
。
设铁元素总质量为xkg

![]() .
.
![]() 中铁的质量为:
中铁的质量为:![]() .
.
又设得到![]() 质量为ykg
质量为ykg
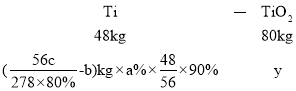
![]() kg
kg
故答案为:![]() 10-3。
10-3。

 七星图书口算速算天天练系列答案
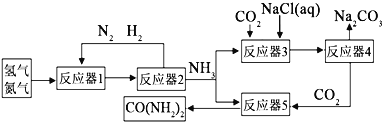
七星图书口算速算天天练系列答案【题目】将0.4mol N2气体和1mol H2气体在2L固定的容器内混合,在一定条件下发生反应:N2(g)+3H2(g)2NH3(g),若2min后测得NH3的浓度为0.2molL-1,
(1)2min时H2的转化率为______。
(2)2min时三种气体的总量为_____mol。
(3)相同温度下,若2min后该反应达平衡,则反应前后的气体压强比为___ 。
(4)下列措施能增大反应速率的是___(填字母)。
A.恒温恒容充入He气 B.缩小体积,使压强增大
C.恒温恒压充入He气 D.使用催化剂
(5)从化学键的角度分析,化学反应的过程就是反应物的化学键的破坏和生成物的化学键的形成过程。已知:1molN2和3molH2反应生成2molNH3时放出热量93kJ:
化学键 | H-H | N-H | N≡N |
键能kJ/rmol | 436 | a | 945 |
试根据表中所列键能数据计算a的数值______。