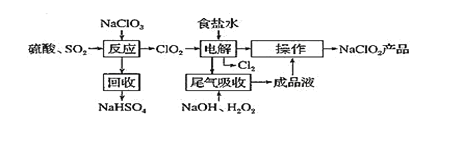
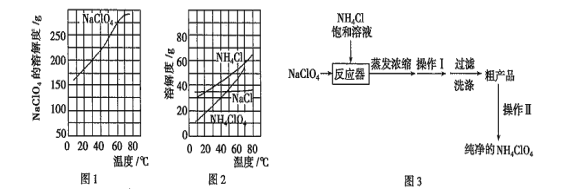
【题目】工业上回收利用某合金废料(主要含Fe、Cu、Co、Li等,已知Co、Fe都是中等活泼金属)的工艺流程如下:
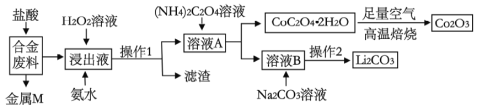
(1)合金废料中加入盐酸浸取,此处盐酸不能换为硝酸,原因是_______________。
(2)操作1用到的玻璃仪器有__________________________。
(3)浸出液中加入H2O2溶液和氨水,应先加入_____________,加入氨水发生反应的离子方程式为____________________。
(4)在空气中焙烧CoC2O4·2H2O的化学方程式是____________________。
(5)已知Li2CO3微溶于水,其饱和溶液的浓度与温度关系见下表
温度/℃ | 10 | 30 | 60 | 90 |
浓度/molL-1 | 0.21 | 0.17 | 0.14 | 0.10 |
则操作2的具体流程是_______________、_____________、洗涤、干燥。