题目内容
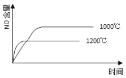
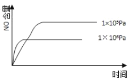
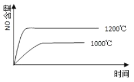
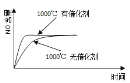
【题目】高氯酸铵(NH4ClO4)常作火箭发射的推进剂,实验室可用NaClO4、NH4Cl等原料制取(部分物质溶解度如图1、图2),其实验流程如图3所示,回答下列问题:
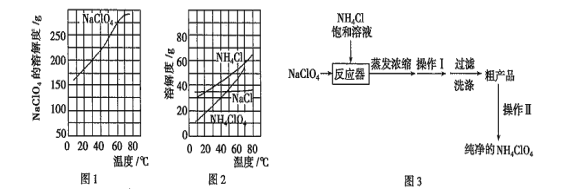
(1)反应器中发生反应的基本反应类型是____________________。
(2)上述流程中操作Ⅰ为_____,操作Ⅱ为________。
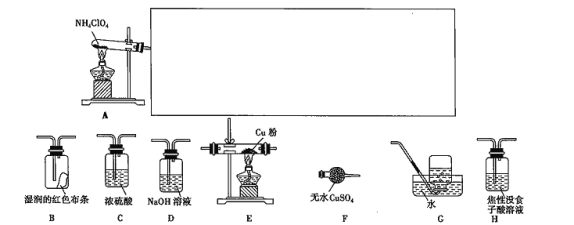
(3)已知NH4ClO4在400 ℃时开始分解为N2、Cl2、O2、H2O。某课题组设计实验探究NH4ClO4的分解产物(假设装置内药品均足量,部分夹持装置已省略;实验开始前,已用CO2气体将整套实验装置中的空气排尽;焦性没食子酸溶液用于吸收氧气)。
①写出高氯酸铵分解的化学方程式:_______________________。
②为了验证上述产物,按气流从左至右,装置的连接顺序为A→_______________ (填装置的字母),证明氧气存在的实验现象为__________________。
③若装置E硬质玻璃管中的Cu粉换成Mg粉,向得到的产物中滴加蒸馏水,产生能使湿润的红色石蕊试纸变蓝色的气体。滴加蒸馏水发生反应的化学方程式为___________。
【答案】复分解反应 冷却结晶 重结晶 2NH4ClO4![]() N2↑+Cl2↑+2O2↑+4H2O↑ F→B→D→C→E→H→G 装置E硬质玻璃管中的红色粉末变为黑色 Mg3N2+6H2O=3Mg(OH)2+2NH3↑
N2↑+Cl2↑+2O2↑+4H2O↑ F→B→D→C→E→H→G 装置E硬质玻璃管中的红色粉末变为黑色 Mg3N2+6H2O=3Mg(OH)2+2NH3↑
【解析】
由图可知,NaClO4的溶解度受温度的影响较大,NaCl溶解度受温度影响不大,80℃时浸取液冷却至0℃过滤,NaClO4的溶解度迅速降低,析出晶体,NaClO4中加入氯化铵的饱和溶液,可转化为更难溶的沉淀,根据物质溶解情况,可以知道析出高氯酸铵,过滤洗涤干燥就可以得到高氯酸铵固体;高氯酸铵的分解产物先通过盛装无水CuSO4粉末的F装置,再通过润湿的红色布条,然后利用盛装NaOH溶液的试剂瓶吸收Cl2,利用浓硫酸干燥气体,气体气体通过Cu粉可用于检验O2,G装置利用排水集气法用于检验N2,由于O2也难溶于水,因此需要先用焦性没食子酸吸收O2,以此解答。
(1)由流程可知,反应器中发生的反应为:NaClO4+NH4Cl=NH4Cl+NaCl,该反应为复分解反应;
(2)蒸发浓缩后经过操作I可以过滤,NH4ClO4的溶解度随温度的升高而升高,因此操作Ⅰ为冷却结晶;经过操作Ⅱ将粗产品得到纯净的产品,因此操作Ⅱ为重结晶;
(3)①由题干可知,NH4ClO4分解生成N2、Cl2和H2O,结合原子守恒可知生成物中还有O2,因此反应方程式为:2NH4ClO4![]() N2↑+Cl2↑+2O2↑+4H2O↑;
N2↑+Cl2↑+2O2↑+4H2O↑;
②対生成的气体进行检验时,应先用无水CuSO4固体检验水蒸气,再用湿润的红色布条检验Cl2, O2用O2与Cu结合变为黑色进行检验,G装置排水集气法用于检验N2,由于O2也难溶于水,因此需要先用焦性没食子酸吸收O2,因此装置的连接顺序为:A→F→B→D→C→E→H→G;证明O2存在的实验现象为E中红色的粉末变为黑色;
③Mg能与N2反应生成Mg3N2,Mg3N2与水反应生成能使湿润的红色石蕊试纸变蓝的气体为NH3,因此反应方程式为:Mg3N2+6H2O=3Mg(OH)2+2NH3↑。