题目内容
【题目】(1)已知:2H2(g) + O2(g) == 2H2O(g);△H= –483.6 kJ·mol-1, H2(g) + ![]() O2(g) == H2O(l) △H=–285.8 kJ·
O2(g) == H2O(l) △H=–285.8 kJ·![]() ,由此可知,在等温下蒸发45g液态水需吸收___________kJ的热量。
,由此可知,在等温下蒸发45g液态水需吸收___________kJ的热量。
(2)工业制氢气的一个重要反应是:CO(g)+H2O(g)==CO2(g)+H2(g),已知25℃时:
C(石墨)+O2(g)==CO2(g)△H1=-394kJ·mol-1
C(石墨)+![]() O2(g)==CO(g)△H2=-111kJ·mol-1
O2(g)==CO(g)△H2=-111kJ·mol-1
H2(g)+![]() O2(g)==H2O(g)△H3=-242kJ·mol-1
O2(g)==H2O(g)△H3=-242kJ·mol-1
试计算25℃时CO(g)+H2O(g)==CO2(g)+H2(g)的△H=______kJ·mol-1
(3) 在25℃、101KPa时,___时所放出的热量,叫做该反应的燃烧热。在25℃、101KPa时,1g乙醇完全燃烧生成CO2和液态水时放热29.713kJ,则能表示乙醇燃烧热的热化学方程式为________。
【答案】110 -41 1mol纯物质完全燃烧生成稳定的氧化物 C2H5OH(l)+3O2(g)═2CO2(g)+3H2O(l)△H=-1366.8 kJmol-1
【解析】
(1) ①2H2(g) + O2(g) == 2H2O(g);△H= –483.6 kJ·mol-1,
②H2(g) + ![]() O2(g) == H2O(l) △H=–285.8 kJ·
O2(g) == H2O(l) △H=–285.8 kJ·![]() ,
,
根据盖斯定律计算①-②×2得到:H2O(l)= H2O(g) △H=+44kJ/mol,蒸发45g液态水物质的量![]() ,需吸收的热量
,需吸收的热量![]() ;
;
(2)已知在25℃时:
(1)C(石墨)![]() ═
═![]()
(2)![]() ═
═![]()
(3)C(石墨)![]() ═
═![]()
由盖斯定律,(3)-(2)-(1)得![]() ═
═![]() ,
,
(3)燃烧热是指:在25℃、101kPa时,1mol纯净物完全燃烧生成稳定的氧化物放出的热量;1g乙醇完全燃烧生成![]() 和液态水时放热
和液态水时放热![]() ,则1mol乙醇,质量为46g,完全燃烧生成稳定的氧化物放出的热量为:
,则1mol乙醇,质量为46g,完全燃烧生成稳定的氧化物放出的热量为:![]() ,其燃烧热的热化学方程式为:
,其燃烧热的热化学方程式为:![]() ═
═![]() 。
。

【题目】某兴趣小组同学进行乙醛的银镜反应实验的操作步骤如下:
A.在试管里先注入少量NaOH溶液,振荡,然后加热煮沸。把NaOH溶液倒去后,再用蒸馏水洗净试管备用。B.在洗净的试管里配制银氨溶液。C.沿试管壁加入乙醛稀溶液。D.加热。请回答下列问题:
(1)步骤A中加NaOH溶液振荡,加热煮沸的目是___。
(2)简述银氨溶液的配制过程:___。
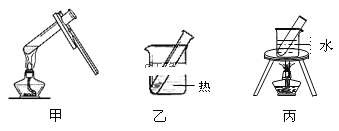
(3)步骤D应选择的加热方法是___(填下列装置编号),理由是___。
(4)乙醛发生银镜反应的化学方程式___。
(5)该兴趣小组的同学还对乙醛进行银镜反应的最佳实验条件进行了探究(部分实验数据如下表):
实验变量 实验序号 | 银氨溶液的量/mL | 乙醛的量/滴 | 温度/℃ | 反应混合液的pH | 出现银镜的时间/min |
1 | 1 | 3 | 65 | 11 | 5 |
2 | 1 | 3 | 45 | 11 | 6.5 |
3 | 1 | 5 | 65 | 11 | 4 |
①实验1和实验2,探究的是___。
②当银氨溶液的量为1mL,乙醛的量为3滴,温度为50℃,反应混合液pH为11时,出现银镜的时间___。(填范围)
③你认为探究乙醛进行银镜反应的最佳条件,除了测量银镜出现的时间外,还需要比较不同条件下形成银镜的___。
(6)银氨溶液放久后会产生氮化银而引起爆炸,直接排放会污染环境,且造成银资源的浪费。实验室从反应后的废液中回收银的实验流程如下:

已知:[Ag(NH3)2]![]() 在溶液中存在平衡:[Ag(NH3)2]+
在溶液中存在平衡:[Ag(NH3)2]+![]() Ag
Ag![]() +2NH3。
+2NH3。
①写出废液与稀HNO3反应的离子方程式___。
②加入的铁粉要过量的目的是___。
③该实验过程中可能产生的大气污染物是___。
【题目】高炉炼铁的主要反应为:3CO(g)+Fe2O3(s)3CO2(g)+2Fe(s),已知该反应在不同温度下的平衡常数如下:
温度/℃ | 1000 | 1150 | 1300 |
平衡常数 | 4.0 | 3.7 | 3.5 |
下列说法正确的是( )
A.增加Fe2O3固体可以提高CO的转化率
B.减小容器体积既能提高反应速率又能提高平衡转化率
C.该反应的正反应ΔH<0
D.当容器内气体密度恒定时,不标志该反应已达到平衡状态