��Ŀ����
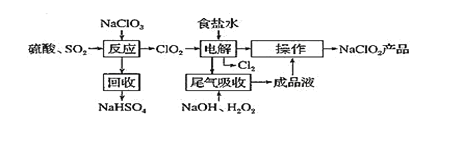
����Ŀ��NaClO2 ��һ����Ҫ��ɱ����������Ҳ������Ư��֯��ȣ�һ������NaClO2 �Ĺ������£�
��֪����ClO2��һ��ǿ���������壬Ũ�ȴ�ʱ�ֽⱬը��������ʹ��ʱҪ��ϡ�����������Ƚ���ϡ�ͣ�ͬʱ������ա��ȡ���NaClO2������Һ���¶ȵ���38��ʱ�����ľ�����NaClO2��33H2O������38��ʱ�����ľ�����NaClO2������60��ʱNaClO2�ֽ��NaClO3��NaCl���ش��������⣺
(1)�����ѧ����������Ӧ������Ļ������о�����H2C2O4����SO2�Ʊ�ClO2���·������÷����Ļ�ѧ����ʽΪ______________________��
(2)��ò�ƷNaClO2�����������������²��裺
����ѹ��55�������ᾧ�������ȹ��ˣ���___________________________������60������õ���Ʒ��
(3)Ϊ�˲ⶨ��ƷNaClO2�Ĵ��ȣ�ȡ�������ò�Ʒ12.5g����ˮ���1L��Һ��ȡ��10.00mL��Һ����ƿ�У��ټ��������ữ��KI��Һ����ַ�Ӧ��(ClO2������ԭΪCl�����ʲ��μӷ�Ӧ)������2~3�ε�����Һ����0.25molL��1Na2S2O3��Һ�ζ����ﵽ�ζ��յ�ʱ��ȥ��Һ20.00mL���Լ����ƷNaClO2�Ĵ���_________________________(��ʾ��2Na2S2O3+I2=Na2S4O6+2NaI)

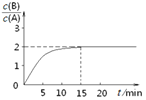
(4)NaClO2��Һ�д���ClO2��HClO2��ClO2����Cl�����ֺ����������ⶨ 25����������Ũ���� pH �ı仯�����ͼ��ʾ(Cl��û�л���)
������������NaClO2��Һ�д���Cl����ԭ����_______________________(�����ӷ���ʽ����)��
��pH=5ʱ��NaClO2��Һ��ClO2��HClO2��ClO2����Cl�����ֺ�������Ũ���ɴ�С��˳����___________________________________________________��
���𰸡�2NaClO3+H2C2O4+H2SO4=Na2SO4+2H2O+2CO2��+2ClO2�� ��38��~60�����ˮϴ�� 90.5% 5ClO2-+4H+![]() 4ClO2+Cl-+2H2O c(HClO2)>c(ClO2��)>c(ClO2)>c(Cl��)
4ClO2+Cl-+2H2O c(HClO2)>c(ClO2��)>c(ClO2)>c(Cl��)
��������
���Ʊ����̿�֪��NaClO3��SO2�������ữ�������·�Ӧ����ClO2������NaClO3�������������ղ���ΪNaHSO4��˵�������������ƣ�������ClO2�����ݵ���غ�ɵ÷�Ӧ�ķ���ʽΪ2NaClO3+SO2+H2SO4=2NaHSO4+2ClO2��ѡ��NaOH��ȥʳ��ˮ�е�Mg2+ѡ��̼���Ƴ�ȥCa2+�����װ��������ClO2�õ�������ClO2-������Cl-ʧ��������Cl2����H2O2��NaOH��Һ����ClO2������ΪClO2-�����NaClO2��Һ�ᾧ������õ���Ʒ���Դ˷�������
��1���������ữ�IJ�����Һ��ԭ�����ƣ���Ӧ���������ơ�CO2��ClO2��ˮ����Ӧ����ʽΪ��2NaClO3+H2C2O4+H2SO4=Na2SO4+2H2O+2CO2��+2ClO2����
��2����ò�ƷNaClO2���������Ϣ��֪Ӧ��38��~60�����ˮϴ�ӣ�
��3��NaClO2�������ữ��KI��Һ��Ӧ������ʽΪ��ClO2-+4I-+4H+=2H2O+2I2+Cl-������ݹ�ϵNaClO2~2I2~4S2O32-��֪NaClO2�����ʵ���Ϊ![]() =1.25��10-3mol��10ml��Ʒ��m(NaClO2)= 1.25��10-3mol��90.5g/mol�����ԭ��Ʒ��NaClO2����������Ϊ
=1.25��10-3mol��10ml��Ʒ��m(NaClO2)= 1.25��10-3mol��90.5g/mol�����ԭ��Ʒ��NaClO2����������Ϊ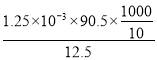 ��100%=90.5%��
��100%=90.5%��
��4����������Һ��NaClO2����������Ӧ����NaCl��ClO2�����ӷ���ʽΪ��5ClO2-+4H+![]() 4 ClO2+Cl-+2H2O��
4 ClO2+Cl-+2H2O��
����ͼ���֪��pH=5ʱ�������ķ�ӦΪ��5ClO2-+4H+![]() 4 ClO2+Cl-+2H2O��NaClO2��Һ�к���Ԫ�ص���Ũ�ȵĴ�С��ϵΪ��c(HClO2)>c(ClO2��)>c(ClO2)>c(Cl��)
4 ClO2+Cl-+2H2O��NaClO2��Һ�к���Ԫ�ص���Ũ�ȵĴ�С��ϵΪ��c(HClO2)>c(ClO2��)>c(ClO2)>c(Cl��)

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�