【题目】实验室常利用甲醛法测定(NH4)2SO4样品中氮的质量分数,其反应原理为:4NH![]() +6HCHO=3H++6H2O+(CH2)6N4H+[滴定时,1 mol (CH2)6N4H+与1 mol H+相当],然后用NaOH标准溶液滴定反应生成的酸。某兴趣小组用甲醛法进行了如下实验:
+6HCHO=3H++6H2O+(CH2)6N4H+[滴定时,1 mol (CH2)6N4H+与1 mol H+相当],然后用NaOH标准溶液滴定反应生成的酸。某兴趣小组用甲醛法进行了如下实验:
步骤Ⅰ 称取样品1.5 g;
步骤Ⅱ 将样品溶解后,完全转移到250 mL容量瓶中,定容,充分摇匀;
步骤Ⅲ 移取25.00 mL样品溶液于250 mL锥形瓶中,加入10 mL 20%的中性甲醛溶液,摇匀、静置5 min后,加入1~2滴酚酞溶液,用NaOH标准溶液滴定至终点。按上述操作方法再重复2次。
(1)根据步骤Ⅲ填空:
①NaOH标准溶液盛放在____滴定管中,若滴定管用蒸馏水洗涤后,直接加入NaOH标准溶液进行滴定,则测得样品中氮元素的质量分数________(填“偏大”“偏小”或“无影响”)。
②滴定达到终点时,酚酞指示剂由________色变成________色。
③下列有关实验操作的说法正确的是__________(双选)。
A.锥形瓶用蒸馏水洗涤后,水未倒尽,则滴定时用去NaOH标准溶液的体积不变
B.滴定终点时,俯视读数,使测定结果偏小
C.只能选用酚酞作指示剂
D.滴入最后一滴NaOH溶液,溶液突然变色,即为滴定终点
E.滴定时,左手控制滴定管活塞,右手握持锥形瓶,边滴边振荡,眼睛注视滴定管中的液面
(2)滴定结果如下表所示:
滴定次数 | 待测溶液的体积/mL | 标准溶液的体积/mL | |
滴定前刻度 | 滴定后刻度 | ||
1 | 25.00 | 1.02 | 21.03 |
2 | 25.00 | 2.00 | 21.99 |
3 | 25.00 | 0.20 | 20.20 |
则所用去的NaOH标准溶液的平均体积为_______ mL,若NaOH标准溶液的浓度为0.100 0 mol·L-1,则该样品中氮元素的质量分数为___________。(列出计算式并计算结果)
【题目】某兴趣小组以废铁屑制得硫酸亚铁铵后,按下列流程制备二水合草酸亚铁(FeC2O4·2H2O),进一步制备高纯度还原铁粉。
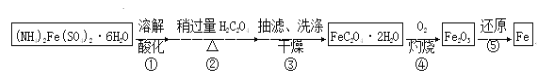
已知:FeC2O4·2H2O难溶于水,150℃开始失结晶水;H2C2O4易溶于水,溶解度随温度升高而增大。
请回答:
(1)下列操作或描述正确的是________。
A.步骤②,H2C2O4稍过量主要是为了抑制Fe2+水解
B.步骤③,采用热水洗涤可提高除杂效果
C.步骤③,母液中的溶质主要是(NH4)2SO4和H2C2O4
D.步骤③,如果在常压下快速干燥,温度可选择略高于100℃
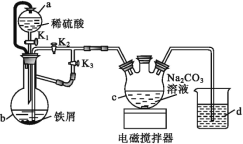
(2)如图装置,经过一系列操作完成步骤③中的抽滤和洗涤。请选择合适的编号,按正确的操作顺序补充完整(洗涤操作只需考虑一次):

开抽气泵→a→b→d→________→c→关抽气泵。
a.转移固液混合物;b.关活塞A;c.开活塞A;d.确认抽干;e.加洗涤剂洗涤
抽滤和普通过滤相比,优点是___________________________________________。
(3) 称取一定量的FeC2O4·2H2O试样,用硫酸溶解,
采用KMnO4滴定法测定,折算结果如下:
n(Fe2+)/mol | n( | 试样中FeC2O4·2H2O的质量分数 |
9.80×10ˉ4 | 9.80×10ˉ4 | 0.980 |
由表中数据推测试样中最主要的杂质是____________________。
(4)实现步骤④必须用到的两种仪器是____________________
(供选仪器:a.烧杯;b.坩埚;c.蒸馏烧瓶;d.高温炉;e.表面皿;f.锥形瓶);
该步骤的化学方程式是______________________________________。
(5)为实现步骤⑤,不宜用碳粉还原Fe2O3,理由是________________________________。