题目内容
【题目】实验室常利用甲醛法测定(NH4)2SO4样品中氮的质量分数,其反应原理为:4NH![]() +6HCHO=3H++6H2O+(CH2)6N4H+[滴定时,1 mol (CH2)6N4H+与1 mol H+相当],然后用NaOH标准溶液滴定反应生成的酸。某兴趣小组用甲醛法进行了如下实验:
+6HCHO=3H++6H2O+(CH2)6N4H+[滴定时,1 mol (CH2)6N4H+与1 mol H+相当],然后用NaOH标准溶液滴定反应生成的酸。某兴趣小组用甲醛法进行了如下实验:
步骤Ⅰ 称取样品1.5 g;
步骤Ⅱ 将样品溶解后,完全转移到250 mL容量瓶中,定容,充分摇匀;
步骤Ⅲ 移取25.00 mL样品溶液于250 mL锥形瓶中,加入10 mL 20%的中性甲醛溶液,摇匀、静置5 min后,加入1~2滴酚酞溶液,用NaOH标准溶液滴定至终点。按上述操作方法再重复2次。
(1)根据步骤Ⅲ填空:
①NaOH标准溶液盛放在____滴定管中,若滴定管用蒸馏水洗涤后,直接加入NaOH标准溶液进行滴定,则测得样品中氮元素的质量分数________(填“偏大”“偏小”或“无影响”)。
②滴定达到终点时,酚酞指示剂由________色变成________色。
③下列有关实验操作的说法正确的是__________(双选)。
A.锥形瓶用蒸馏水洗涤后,水未倒尽,则滴定时用去NaOH标准溶液的体积不变
B.滴定终点时,俯视读数,使测定结果偏小
C.只能选用酚酞作指示剂
D.滴入最后一滴NaOH溶液,溶液突然变色,即为滴定终点
E.滴定时,左手控制滴定管活塞,右手握持锥形瓶,边滴边振荡,眼睛注视滴定管中的液面
(2)滴定结果如下表所示:
滴定次数 | 待测溶液的体积/mL | 标准溶液的体积/mL | |
滴定前刻度 | 滴定后刻度 | ||
1 | 25.00 | 1.02 | 21.03 |
2 | 25.00 | 2.00 | 21.99 |
3 | 25.00 | 0.20 | 20.20 |
则所用去的NaOH标准溶液的平均体积为_______ mL,若NaOH标准溶液的浓度为0.100 0 mol·L-1,则该样品中氮元素的质量分数为___________。(列出计算式并计算结果)
【答案】碱式 偏大 无 粉红(或浅红) AB 20.00 18.67%
【解析】
本实验的目的是通过滴定实验测定硫酸铵样品中氮的质量分数,先使铵根与甲醛发生反应4NH![]() +6HCHO=3H++6H2O+(CH2)6N4H+,1 mol (CH2)6N4H+与1 mol H+相当,所以再用NaOH标准液滴定溶液中(CH2)6N4H+和H+,根据实验数据计算出铵根的物质的量,继而确定样品中氮的质量分数。
+6HCHO=3H++6H2O+(CH2)6N4H+,1 mol (CH2)6N4H+与1 mol H+相当,所以再用NaOH标准液滴定溶液中(CH2)6N4H+和H+,根据实验数据计算出铵根的物质的量,继而确定样品中氮的质量分数。
(1)①NaOH溶液显碱性,应盛放在碱式滴定管中;若滴定管用蒸馏水洗涤后,直接加入NaOH标准溶液进行滴定,会将标准液稀释,从而使滴定时消耗的标准液体积偏大,使测定结果偏大;
②待测液显酸性,所以滴定开始时溶液为无色,酚酞变色的pH范围为8.2~10,滴定终点显弱碱性,此时为粉红色,所以滴定达到终点时,酚酞指示剂由无色变为粉红(或浅红)色,且在30s内不褪去;
③A.锥形瓶用蒸馏水洗涤后,水未倒尽,并未影响待测液中溶质的物质的量,所以滴定时用去NaOH标准溶液的体积不变,故A正确;
B.滴定管的0刻度在上方,所以俯视读数会使读取的标准液体积偏小,测定结果偏小,故B正确;
C.滴定终点溶液呈中性,可以选用甲基橙作指示剂,故C错误;
D.滴入最后一滴NaOH溶液,溶液突然变色不能说明达到滴定终点,应是溶液变色后且半分钟内不褪色,才达到滴定终点,故D错误;
E.滴定时眼睛要注视锥形瓶,观察锥形瓶内颜色变化,故E错误;
综上所述选AB;
(2)三次实验所用标准液体积分别为21.03mL-1.02mL=20.01mL,21.99mL-2.00mL=19.99mL,20.20mL-0.20mL=20.00mL,所以平均体积为![]() =20.00mL;
=20.00mL;
根据反应方程式可知存在数量关系n(NH![]() )= n[H++(CH2)6N4H+],1 mol (CH2)6N4H+与1 mol H+相当,所以n[H++(CH2)6N4H+]=n(NaOH),所以n(NH
)= n[H++(CH2)6N4H+],1 mol (CH2)6N4H+与1 mol H+相当,所以n[H++(CH2)6N4H+]=n(NaOH),所以n(NH![]() )= n(NaOH),则25.00mL待测液中n(NH
)= n(NaOH),则25.00mL待测液中n(NH![]() )=0.02L×0.1000 mol·L-1=0.002mol,则样品中n(NH
)=0.02L×0.1000 mol·L-1=0.002mol,则样品中n(NH![]() )=0.002mol×
)=0.002mol×![]() =0.02mol,则样品中n(N)=0.02mol,所以氮的质量分数为
=0.02mol,则样品中n(N)=0.02mol,所以氮的质量分数为![]() =18.67%。
=18.67%。

【题目】辉铜矿是一种重要的铜矿石,主要含有硫化亚铜(Cu2S),还有Fe2O3、SiO2及一些不溶性杂质。一种以辉铜矿石为原料制备硝酸铜晶体的工艺流程如下:

已知:部分金属阳离子生成氢氧化物沉淀的pH范围如下表所示(开始沉淀的pH按金属离子浓度为1.0mol/L计算)
离子 | 开始沉淀的pH | 完全沉淀的pH |
Fe3+ | 1.1 | 3.2 |
Mn2+ | 8.3 | 9.8 |
Cu2+ | 4.4 | 6.4 |
回答下列问题
(1)浸取后得到的浸出液中含有CuSO4、MnSO4。写出浸取时产生CuSO4、MnSO4反应的化学方程式__________。
(2)调节pH的目的是___________,pH的调节范围为___________。
(3)生成MnCO3沉淀的离子方程式为___________。
(4)操作A为___________。
(5)由辉铜矿制取铜的反应过程可以表示为:
2Cu2S(s)+3O2(g)═ 2Cu2O(s)+ 2SO2(g)△H=﹣768.2kJ/mol
2Cu2O(s)+ Cu2S(s)═ 6Cu(s)+ SO2(g)△H=" +116.0" kJ/mol
则由Cu2S与O2加热反应生成Cu的热化学方程式为___________。
(6)若用含85% Cu2S(Mr=160)的辉铜矿来制备无水Cu(NO3)2,假设浸取率为95%,调节pH时损Cu 3%,蒸氨过程中有5%未转化为CuO,其它过程中无损耗,则1.6 kg这样的辉铜矿最多能制备__________mol无水Cu(NO3)2。(计算结果精确到小数点后1位)
【题目】某兴趣小组以废铁屑制得硫酸亚铁铵后,按下列流程制备二水合草酸亚铁(FeC2O4·2H2O),进一步制备高纯度还原铁粉。
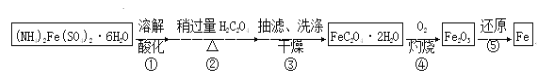
已知:FeC2O4·2H2O难溶于水,150℃开始失结晶水;H2C2O4易溶于水,溶解度随温度升高而增大。
请回答:
(1)下列操作或描述正确的是________。
A.步骤②,H2C2O4稍过量主要是为了抑制Fe2+水解
B.步骤③,采用热水洗涤可提高除杂效果
C.步骤③,母液中的溶质主要是(NH4)2SO4和H2C2O4
D.步骤③,如果在常压下快速干燥,温度可选择略高于100℃
(2)如图装置,经过一系列操作完成步骤③中的抽滤和洗涤。请选择合适的编号,按正确的操作顺序补充完整(洗涤操作只需考虑一次):

开抽气泵→a→b→d→________→c→关抽气泵。
a.转移固液混合物;b.关活塞A;c.开活塞A;d.确认抽干;e.加洗涤剂洗涤
抽滤和普通过滤相比,优点是___________________________________________。
(3) 称取一定量的FeC2O4·2H2O试样,用硫酸溶解,
采用KMnO4滴定法测定,折算结果如下:
n(Fe2+)/mol | n( | 试样中FeC2O4·2H2O的质量分数 |
9.80×10ˉ4 | 9.80×10ˉ4 | 0.980 |
由表中数据推测试样中最主要的杂质是____________________。
(4)实现步骤④必须用到的两种仪器是____________________
(供选仪器:a.烧杯;b.坩埚;c.蒸馏烧瓶;d.高温炉;e.表面皿;f.锥形瓶);
该步骤的化学方程式是______________________________________。
(5)为实现步骤⑤,不宜用碳粉还原Fe2O3,理由是________________________________。