题目内容
【题目】硫是一种自然界分布较广的元素,在很多化合物中都含有该元素,回答下列问题:


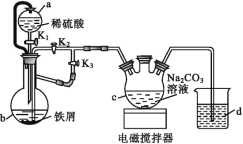
(1)装置A中反应的化学方程式为______________________________________。
(2)使分液漏斗中液体顺利流下的操作是_________________________。
(3)选用上面的装置和药品探究亚硫酸与次氯酸的酸性强弱:
①甲同学认为按照A→C→F的顺序连接装置即可证明,乙同学认为该方案不合理,其理由是_________
②丙同学设计的合理实验方案为A→C→________→________→D→F,其中装置C的作用是______,证明亚硫酸的酸性强于次氯酸的实验现象是____________
(4)K2S2O8具有强氧化性,可通过电解H2SO4和K2SO4的混合溶液制得,其阳极反应式为_________,称取0.250 0 g 产品于碘量瓶中,加100 mL水溶解,再加入8.000 g KI固体(稍过量),振荡使其充分反应;加入适量醋酸溶液酸化,以淀粉为指示剂,用 c mol/L的Na2S2O3标准液滴定至终点,消耗Na2S2O3标准液V mL,则样品中K2S2O8的纯度为________%(用含c、V的代数式表示,已知:S2O82-+2I-===2SO42-+I2 ;2S2O32-+I2===2S4O82-+2I- )。
【答案】CaSO3+2HCl===CaCl2+SO2↑+H2O 拔下分液漏斗颈部的塞子(或使分液漏斗瓶塞上的凹槽对准瓶颈的小孔),然后再旋转下部活塞 SO2通入次氯酸钙溶液发生氧化还原反应,不能证明强酸制备弱酸的原理,既无法比较亚硫酸与次氯酸酸性强弱 B E 除去HCl气体 D中品红不褪色,F中出现白色沉淀 2SO42--2e-===S2O82- 54cV
【解析】
(1)亚硫酸根与盐酸反应可生成二氧化硫;
(2)使分液漏斗中液体顺利流下,应使分液漏斗内外压强相等;
(3)①次氯酸与二氧化硫之间发生氧化还原反应;
②根据反应中可能混有HCl,之后含有SO2造成干扰,故需依次除去;
(4)可利用反应物之间关系式S2O82-~2S2O32-计算。
(1)盐酸与亚硫酸钙反应生成氯化钙、二氧化硫与水,反应方程式为CaSO3+2HCl===CaCl2+SO2↑+H2O;
(2)分液漏斗使用时应使内外压强平衡,故操作为:拔下分液漏斗颈部的塞子(或使分液漏斗瓶塞上的凹槽对准瓶颈的小孔),然后再旋转下部活塞;
(3)①次氯酸具有强氧化性、二氧化硫具有还原性,两者可发生氧化还原反应;
②A装置制备二氧化硫,由于盐酸易挥发,制备的二氧化硫中混有HCl,用饱和的亚硫酸氢钠除去HCl,再通过碳酸氢钠溶液,可以验证亚硫酸酸性比碳酸强,用酸性高锰酸钾溶液氧化除去二氧化碳中的二氧化硫,用品红溶液检验二氧化碳中二氧化硫是否除尽,再通入F中,则:装置连接顺序为A、C、B、E、D、F,其中装置C的作用是除去HCl气体,D中品红不褪色,F中出现白色沉淀,可证明亚硫酸的酸性强于次氯酸;
(4)阳极硫酸根离子失电子,化合价升高,对应电极反应为2SO42--2e-= S2O82-; 由关系式可知S2O82-~2S2O32-,则样品中K2S2O8的纯度为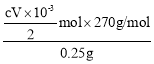 ×100%=54cV %。
×100%=54cV %。

 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案