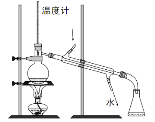
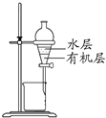
【题目】乙醛在氧化铜作催化剂的条件下,可以被空气氧化成乙酸。依据此原理设计实验制得并在试管C中收集到少量乙酸溶液(如图所示,试管A中装有40%的乙醛水溶液、氧化铜粉末;烧杯B中装有某液体)。已知在60℃~80℃时用双连打气球鼓入空气即可发生乙醛的氧化反应,连续鼓入十几次反应基本完全。有关物质的沸点见表:
物质 | 乙醛 | 乙酸 | 甘油 | 乙二醇 | 水 |
沸点(℃) | 20.8 | 117.9 | 290 | 197.2 | 100 |
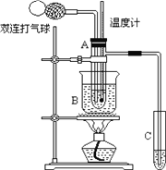
请回答下列问题:
(1)试管A内在60℃~80℃时发生的主要反应的化学方程式为_______________。
(2)如图所示在实验的不同阶段,需要调整温度计在试管A内的位置,在实验开始时温度计水银球的位置应在试管A的反应液中;目的是___________;当试管A内的主要反应完成后温度计水银球的位置应在试管A的支管口处;目的是_________。
(3)烧杯B的作用是使试管A内的反应液均匀受热发生反应,使生成的乙酸变成蒸气进入试管C,烧杯B内盛装的液体可以是____。(写出一种即可,在题给物质中找);某同学认为试管C最好置于冰水浴中,其目的是________。
(4)对C中产品进行蒸馏时,蒸馏烧瓶中加入少量___,以除去其中含有的少量水。
A.浓硫酸 B.CaO C.CuSO4溶液 D.无水CaCl2
(5)以下区分乙酸精品和粗品的方法,合理的是_____。
A.加入水观察实验现象
B.加入足量氢氧化钠溶液后,再加入银氨溶液,水浴加热观察实验现象
C.加入碳酸氢钠溶液,振荡后观察实验现象
D.加入少量Na单质,振荡后观察实验现象
【题目】垃圾是放错地方的资源,工业废料也可以再利用。某化学兴趣小组在实验室中用废弃的含铝、铁、铜的合金制取硫酸铝溶液、硝酸铜晶体和铁红(Fe2O3)。实验方案如下:

(1)写出滤液A中加入足量硫酸后所发生反应的离子方程式:__________________。
(2)已知Fe(OH)3沉淀的pH是3~4,溶液C通过调节pH可以使Fe3+沉淀完全。下列物质中可用作调整溶液C的pH的试剂是________(填序号)。
A.铜粉 | B.氨水 | C.氢氧化铜 | D.碳酸铜 |
(3)常温,若溶液C中金属离子均为1 mol·L-1,Ksp[Fe(OH)3]=4.0×10-38,Ksp[Cu(OH)2]=2.2×10-20。控制pH=4,溶液中c(Fe3+)=____________,此时________Cu(OH)2沉淀生成(填“有”或“无”)。
(4)将20 mL Al2(SO4)3溶液与等物质的量浓度的Ba(OH)2溶液80 mL混合,反应的离子方程式为_______________。
【题目】实验室用H2O2分解反应制取氧气时,常加入催化剂以加快反应速率,某研究性学习小组为研究催化剂FeCl3的量对O2生成速率的影响,设计了如下三组实验方案(见下表),将表中所给的试剂按一定体积混合后进行反应。
实验编号 试剂 | A | B | C |
10% H2O2/mL | 20.0 | V1 | V2 |
2 mol·L-1 FeCl3/ mL | 0 | 5.0 | 10.0 |
H2O/ mL | V3 | V4 | 0 |
按要求回答下列问题:
(1)欲用图装置来比较该反应的反应速率快慢,检查该装置气密性的方法是_______。

(2)当反应物的浓度、用量及其他影响速率的条件确定之后,可以通过测____________________推(计)算反应速率。
(3)为实现实验目的,则V4=____。
(4)已知Fe3+催化H2O2分解的机理可分两步反应进行,其中第一步反应为:2Fe3+ + H2O2 =2Fe2+ + O2↑+ 2H+,则第二步反应的离子方程式为:___________________。
(5)读数时发现,量气装置左端液面低于右端液面,则测得的气体体积_____填“偏大”、“偏小”或“无影响”)
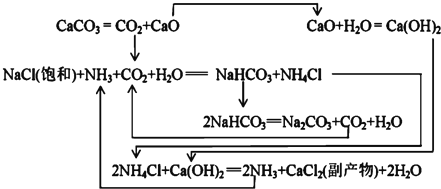
【题目】![]() 年,比利时人索尔维
年,比利时人索尔维![]()
![]() 用氨碱法生产碳酸钠.反应原理如下:
用氨碱法生产碳酸钠.反应原理如下:
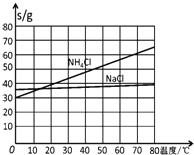
![]() 时一些物质在水中的溶解度
时一些物质在水中的溶解度![]()
NaCl |
|
|
|
|
|
|
|
|
|
(1)氨碱法生成纯碱的原料是____________,可循环利用的物质有____________.
(2)饱和NaCl溶液通![]() 和
和![]() 能生成
能生成![]() 的原因有:____________/span>.
的原因有:____________/span>.
Ⅲ![]() 我国化工专家侯德榜研究出联合制碱法,其反应原理和氨碱法类似,但将制氨和制碱联合,提高了原料利用率.
我国化工专家侯德榜研究出联合制碱法,其反应原理和氨碱法类似,但将制氨和制碱联合,提高了原料利用率.
(3)生产中需向分离出![]() 后所得的溶液中加入NaCl固体并通入
后所得的溶液中加入NaCl固体并通入![]() ,在____________
,在____________![]() 填温度范围
填温度范围![]() 下析出____________
下析出____________![]() 填化学式
填化学式![]()