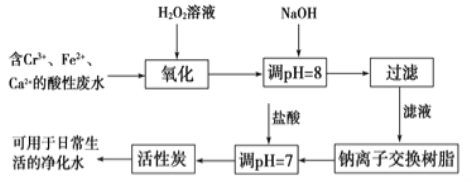
题目内容
【题目】垃圾是放错地方的资源,工业废料也可以再利用。某化学兴趣小组在实验室中用废弃的含铝、铁、铜的合金制取硫酸铝溶液、硝酸铜晶体和铁红(Fe2O3)。实验方案如下:

(1)写出滤液A中加入足量硫酸后所发生反应的离子方程式:__________________。
(2)已知Fe(OH)3沉淀的pH是3~4,溶液C通过调节pH可以使Fe3+沉淀完全。下列物质中可用作调整溶液C的pH的试剂是________(填序号)。
A.铜粉 | B.氨水 | C.氢氧化铜 | D.碳酸铜 |
(3)常温,若溶液C中金属离子均为1 mol·L-1,Ksp[Fe(OH)3]=4.0×10-38,Ksp[Cu(OH)2]=2.2×10-20。控制pH=4,溶液中c(Fe3+)=____________,此时________Cu(OH)2沉淀生成(填“有”或“无”)。
(4)将20 mL Al2(SO4)3溶液与等物质的量浓度的Ba(OH)2溶液80 mL混合,反应的离子方程式为_______________。
【答案】AlO2-+4H+=Al3++2H2O CD 4.0×10-8 无 2Al3++3SO42-+3Ba2++8OH-=3BaSO4↓+2AlO2-+4H2O
【解析】
(1)铁、铜与氢氧化钾不反应,则滤渣B是铁、铜的混合物。滤液A中含有偏铝酸钾和过量的氢氧化钾,因此加入足量硫酸后所发生反应的离子方程式为AlO2-+4H+=Al3++2H2O。
(2)由于不能引入新的杂质,则调节溶液C的pH值时需要用氢氧化铜或碳酸铜,答案选CD。
(3)常温,若溶液C中金属离子均为1 mol·L-1,Ksp[Fe(OH)3]=4.0×10-38,Ksp[Cu(OH)2]=2.2×10-20。控制pH=4,则溶液中氢氧根离子的浓度为1.0×10-10,所以溶液中c(Fe3+)=![]() =4.0×10-8mol/L,此时(1.0×10-10)2×1<2.2×10-20,所以无Cu(OH)2沉淀生成。
=4.0×10-8mol/L,此时(1.0×10-10)2×1<2.2×10-20,所以无Cu(OH)2沉淀生成。
(4)将20 mL Al2(SO4)3溶液与等物质的量浓度的Ba(OH)2溶液80 mL混合,二者的物质的量之比是1:4,所以反应的离子方程式为2Al3++3SO42-+3Ba2++8OH-=3BaSO4↓+2AlO2-+4H2O。

 阅读快车系列答案
阅读快车系列答案