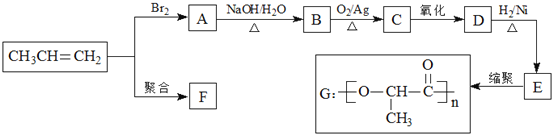
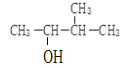
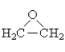
题目内容
【题目】乙醛在氧化铜作催化剂的条件下,可以被空气氧化成乙酸。依据此原理设计实验制得并在试管C中收集到少量乙酸溶液(如图所示,试管A中装有40%的乙醛水溶液、氧化铜粉末;烧杯B中装有某液体)。已知在60℃~80℃时用双连打气球鼓入空气即可发生乙醛的氧化反应,连续鼓入十几次反应基本完全。有关物质的沸点见表:
物质 | 乙醛 | 乙酸 | 甘油 | 乙二醇 | 水 |
沸点(℃) | 20.8 | 117.9 | 290 | 197.2 | 100 |

请回答下列问题:
(1)试管A内在60℃~80℃时发生的主要反应的化学方程式为_______________。
(2)如图所示在实验的不同阶段,需要调整温度计在试管A内的位置,在实验开始时温度计水银球的位置应在试管A的反应液中;目的是___________;当试管A内的主要反应完成后温度计水银球的位置应在试管A的支管口处;目的是_________。
(3)烧杯B的作用是使试管A内的反应液均匀受热发生反应,使生成的乙酸变成蒸气进入试管C,烧杯B内盛装的液体可以是____。(写出一种即可,在题给物质中找);某同学认为试管C最好置于冰水浴中,其目的是________。
(4)对C中产品进行蒸馏时,蒸馏烧瓶中加入少量___,以除去其中含有的少量水。
A.浓硫酸 B.CaO C.CuSO4溶液 D.无水CaCl2
(5)以下区分乙酸精品和粗品的方法,合理的是_____。
A.加入水观察实验现象
B.加入足量氢氧化钠溶液后,再加入银氨溶液,水浴加热观察实验现象
C.加入碳酸氢钠溶液,振荡后观察实验现象
D.加入少量Na单质,振荡后观察实验现象
【答案】2CH3CHO+O2![]() 2CH3COOH 测量反应溶液的温度 收集含乙酸的馏分 乙二醇(或甘油) 有利于乙酸的冷凝收集 D B
2CH3COOH 测量反应溶液的温度 收集含乙酸的馏分 乙二醇(或甘油) 有利于乙酸的冷凝收集 D B
【解析】
本实验的目的是催化氧化乙醛制取乙酸,装置A装乙醛在氧化铜作催化剂、加热至60℃~80℃的条件下生成乙酸,根据实验装置图可知本实验中的加热方式液体加热,根据题意可知反应完成后,需要加热使乙酸变成水蒸气进入收集装置,所以选用的液体的沸点应高于乙酸的沸点,为了更好的收集乙酸,可以收集装置置于冰水浴中。
(1)乙醛与氧气发生氧化反应生成乙酸,反应方程式为:2CH3CHO+O2![]() 2CH3COOH;
2CH3COOH;
(2)实验开始时温度计应测量反应溶液的温度,控制反应温度为60℃~80℃,所以实验开始时温度计水银球的位置应在试管A的反应液中;由蒸馏原理可知,温度计测量的是蒸气的温度,所以温度计水银球的位置应在试管A的支管口处,目的是收集含乙酸的馏分;
(3)用液体加热,能使试管受热均匀,乙酸的沸点为117.9℃,要想通过蒸馏的方法得到乙酸,B内盛装的液体的沸点应大于117.9℃,由表可知烧杯B内盛装的液体可以是乙二醇或甘油;试管C是用来接收乙酸蒸气的,冰水浴能使乙酸蒸气冷凝,有利于乙酸的收集;
(4)除去乙酸中的水,要加能吸收水,而且不与乙酸反应的物质,CaO与乙酸反应、浓硫酸和硫酸铜溶液为液体不能与乙酸分离,所以要加无水氯化钙,故答案为:D;
(5)A.粗品中可能含有乙醛,乙醛也溶于水,所以加入水不能区分,故A错误;
B.加入足量氢氧化钠溶液后,再加入银氨溶液,水浴加热观察实验现象,有银镜生成的,说明为粗品,故B正确;
C.乙酸精品和粗品都含有乙酸,都能碳酸氢钠反应生成气体,不能区别二者,故C错误;
D.乙酸精品和粗品都和钠反应生成氢气,不能区别二者,故D错误;
故答案为:B。

【题目】![]() 年,比利时人索尔维
年,比利时人索尔维![]()
![]() 用氨碱法生产碳酸钠.反应原理如下:
用氨碱法生产碳酸钠.反应原理如下:

![]() 时一些物质在水中的溶解度
时一些物质在水中的溶解度![]()
NaCl |
|
|
|
|
|
|
|
|
|

(1)氨碱法生成纯碱的原料是____________,可循环利用的物质有____________.
(2)饱和NaCl溶液通![]() 和
和![]() 能生成
能生成![]() 的原因有:____________/span>.
的原因有:____________/span>.
Ⅲ![]() 我国化工专家侯德榜研究出联合制碱法,其反应原理和氨碱法类似,但将制氨和制碱联合,提高了原料利用率.
我国化工专家侯德榜研究出联合制碱法,其反应原理和氨碱法类似,但将制氨和制碱联合,提高了原料利用率.
(3)生产中需向分离出![]() 后所得的溶液中加入NaCl固体并通入
后所得的溶液中加入NaCl固体并通入![]() ,在____________
,在____________![]() 填温度范围
填温度范围![]() 下析出____________
下析出____________![]() 填化学式
填化学式![]()