题目内容
【题目】以苯和乙炔为原料合成化工原料E的路线如下:
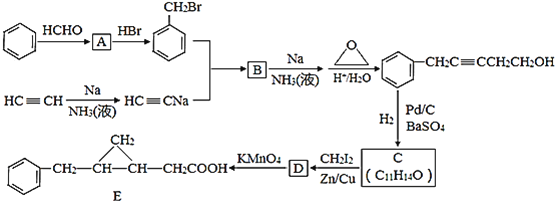
回答下列问题:
(1)以下有关苯和乙炔的认识正确的是 ______
![]() 苯和乙炔都能使溴水褪色,前者为化学变化,后者为物理变化
苯和乙炔都能使溴水褪色,前者为化学变化,后者为物理变化
![]() 苯和乙炔在空气中燃烧都有浓烟产生
苯和乙炔在空气中燃烧都有浓烟产生
![]() 苯与浓硝酸混合,水浴加热55~60℃,生成硝基苯
苯与浓硝酸混合,水浴加热55~60℃,生成硝基苯
![]() 聚乙炔是一种有导电特性的高分子化合物
聚乙炔是一种有导电特性的高分子化合物
(2)A的名称 ______。
(3)生成B的化学方程式为 ______,反应类型是 ______。
(4)C的结构简式为 ______ ,C的分子中一定共面的碳原子最多有 ______ 个。
(5)与D同类别且有二个六元环结构(环与环之间用单键连接)的同分异构体有______种,请任写两种同分异构体的结构简式:______。
(6)参照上述合成路线,设计一条以乙炔和必要试剂合成环丙烷的路线: ______。
【答案】bd 苯甲醇  +HC≡CNa→
+HC≡CNa→ +NaBr 取代反应
+NaBr 取代反应 ![]() 7 4
7 4 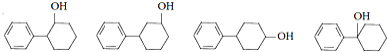
![]()
【解析】
苯与甲醛发生加成反应生成A为![]() ,A与HBr发生取代反应生成
,A与HBr发生取代反应生成![]() ,再与HC≡CNa发生取代反应生成B为
,再与HC≡CNa发生取代反应生成B为![]() ,
,![]() 与H2发生加成反应生成C,结合C的分子式可知C为
与H2发生加成反应生成C,结合C的分子式可知C为![]() ,结合E的结构可知C与CH2I2反应生成D为
,结合E的结构可知C与CH2I2反应生成D为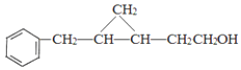 ,D发生氧化反应生成E
,D发生氧化反应生成E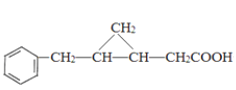 。据此解答。
。据此解答。
(1)a.苯和乙炔都能使溴水褪色,前者为萃取作用,发生的是物理变化,后者发生加成反应,属于化学变化,a错误;
![]() 苯和乙炔的最简式相同都是CH,二者含碳量高,在空气中燃烧都有浓烟产生,b正确;
苯和乙炔的最简式相同都是CH,二者含碳量高,在空气中燃烧都有浓烟产生,b正确;
![]() 苯与浓硝酸混合,水浴加热55~60℃,生成硝基苯和H2O,需要浓硫酸作催化剂,c错误;
苯与浓硝酸混合,水浴加热55~60℃,生成硝基苯和H2O,需要浓硫酸作催化剂,c错误;
![]() 聚乙炔是一种有导电特性的高分子化合物,d正确;
聚乙炔是一种有导电特性的高分子化合物,d正确;
故合理选项是bd;
(2)A结构简式为![]() ,名称为苯甲醇;
,名称为苯甲醇;
(3)生成B的化学方程式为: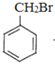 +HC≡CNa→
+HC≡CNa→ +NaBr,反应类型为取代反应;
+NaBr,反应类型为取代反应;
(4)C的结构简式为![]() ,与苯环连接的C原子处于苯环的平面上,碳碳双键连接的原子处于同一平面,由于碳碳单键可以旋转,所以乙烯平面与苯环平面可能不在同一平面上,与-OH连接的C原子是正四面体结构,可能不在乙烯的平面上,所以最多有7个碳原子可以共平面;
,与苯环连接的C原子处于苯环的平面上,碳碳双键连接的原子处于同一平面,由于碳碳单键可以旋转,所以乙烯平面与苯环平面可能不在同一平面上,与-OH连接的C原子是正四面体结构,可能不在乙烯的平面上,所以最多有7个碳原子可以共平面;
(5)与![]()
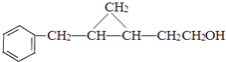
![]() 同类别且有二个六元环结构
同类别且有二个六元环结构![]() 环与环之间用单键连接
环与环之间用单键连接![]() 的同分异构体有:
的同分异构体有: ,共有四种;
,共有四种;
(6)CH≡CH与H2发生加成反应产生CH2=CH2,CH2=CH2与CH2I2发生反应产生环丙烷,所以以乙炔和必要试剂合成环丙烷的路线:![]() 。
。

 互动课堂系列答案
互动课堂系列答案【题目】Ⅰ.能源是国民经济发展的重要基础,我国目前使用的能源主要是化石燃料。
已知:C(s)+O2(g)===CO2(g) ΔH1=-393.5 kJ·mol-1
H2(g)+![]() O2(g)===H2O(g) ΔH2=-241.8 kJ·mol-1
O2(g)===H2O(g) ΔH2=-241.8 kJ·mol-1
CO(g)+![]() O2(g)===CO2(g) ΔH3=-283.0 kJ·mol-1
O2(g)===CO2(g) ΔH3=-283.0 kJ·mol-1
则煤气化主要反应C(s)+H2O(g)=CO(g)+H2(g)的ΔH=____________________。
Ⅱ.为了减少CO的排放,某环境研究小组以CO和H2为原料合成清洁能源二甲醚(DME),反应如下:4H2(g)+2CO(g)![]() CH3OCH3(g)+H2O(g) ΔH=-198 kJ·mol-1。
CH3OCH3(g)+H2O(g) ΔH=-198 kJ·mol-1。
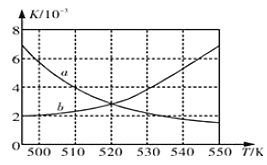
(1)如图所示能正确反映平衡常数K随温度变化关系的曲线为________(填曲线标记字母),其判断理由是____________。
(2)在一定温度下,向2.0 L固定容积的密闭容器中充入2 mol H2和1 mol CO,经过一段时间后,反应4H2(g)+2CO(g)![]() CH3OCH3(g)+H2O(g)达到平衡。反应过程中测得的部分数据见下表:
CH3OCH3(g)+H2O(g)达到平衡。反应过程中测得的部分数据见下表:
时间/min | 0 | 20 | 40 | 80 | 100 |
n(H2)/mol | 2.0 | 1.4 | 0.85 | 0.4 | — |
n(CO)/mol | 1.0 | — | 0.425 | 0.2 | 0.2 |
n(CH3OCH3)/mol | 0 | 0.15 | — | — | 0.4 |
n(H2O)/mol | 0 | 0.15 | 0.2875 | 0.4 | 0.4 |
①0~20 min的平均反应速率v(CO)=__________________mol·L-1·min-1;
②达到平衡时,H2的转化率为__________________;
③在上述温度下,该反应的平衡常数K=______________________;
④能表明该反应达到平衡状态的是________(填序号);
A CO的转化率等于H2O的产率 B 混合气体的平均相对分子质量不变
C v(CO)与v(H2)的比值不变 D 混合气体的密度不变
⑤在上述温度下,向平衡后的2 L容器中再充入0.4 mol H2和0.4 mol CH3OCH3(g),则化学平衡________移动(填“向左”“向右”或“不”)。