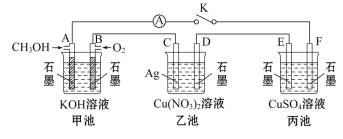
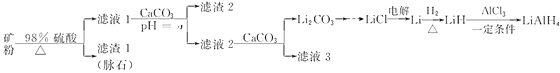
【题目】四氢铝锂(LiAlH4)常作有机合成的重要还原剂。以辉锂矿(主要成分是Li2O·Al2O3·4SiO2,含少量Fe2O3)为原料合成四氢铝锂的流程如下:
已知:①几种金属氢氧化物沉淀的pH如下表所示:
物质 | Fe(OH)3 | Al(OH)3 |
开始沉淀的pH | 2.3 | 4.0 |
完全沉淀的pH | 3.7 | 6.5 |
②常温下,Ksp(Li2CO3)=2.0×10-3,Li2CO3在水中溶解度随着温度升高而减小。
回答下列问题:
(1)上述流程中,提高“酸浸”速率的措施有______________________________________、______________________________________________________________________________(写两条);加入CaCO3的作用是__________________,“a”的最小值为___________。
(2)设计简单方案由Li2CO3制备LiCl:__________。
(3)写出LiH和AlCl3反应的化学方程式为______________________(条件不作要求)。
(4)用热水洗涤Li2CO3固体,而不用冷水洗涤,其目的是________________;检验碳酸锂是否洗净的实验方法是_____________________。
(5)在有机合成中,还原剂的还原能力通常用“有效氢”表示,其含义是1克还原剂相当于多少克氢气的还原能力。LiAlH4的“有效氢”为_________________(结果保留2位小数)。
【题目】某厂废酸主要含硫酸、Fe3+、Fe2+、TiO2+、Al3+ 。利用该废液制备过二硫酸铵[( NH4) 2S2O8]和TiO2的一种工艺流程如下:

已知:i.TiOSO4在热水中易水解生成H2TiO3,相关离子形成氢氧化物沉淀的pH范围如 下表:
金属离子 | TiO2+ | Fe3+ | Fe2+ | Al3+ |
开始沉淀的pH | 1.2 | 1.9 | 7.0 | 3.2 |
沉淀完全的pH | 2.8 | 3.1 | 9.4 | 4.7 |
ii. pH>7 时,Fe2+部分生成 Fe( Ⅱ)氨络离Fe(NH3)2]2+o
请回答下列问题:
(1)加入适量Fe的作用是________________ .
(2)生成TiO(OH)2的化学方程式为_______________ 。
(3)滤渣I、滤渣II均含有的物质的化学式为_____________ .
(4)加入H2O2的目的是除掉Fe( Ⅱ)氨络离子[Fe(NH3)2]2+,此过程中氧化剂与还原剂的物质的量之比理论上等于________ (填数值)。
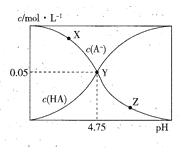
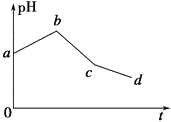
(5)常温下,含硫微粒主要存在形式与pH的关系如下图所示。

用Pt电极电解饱和NH4HSO4溶液制备过二硫酸铵时,为满足在阳极放电的离子主要为 HSO4-,应调节阳极区溶液的pH范围在______之间,其电极反应式为____________ 。
(6)科研人员常用硫酸铁铵[NH4Fe(SO4)2]滴定法测定TiO2的纯度,其步骤为: 用足量酸溶解wg 二氧化钛样品,用铝粉做还原剂,过滤、洗涤,将滤液定容为100 mL,取 25.00 mL,以NH4SCN作指示剂,用标准硫酸铁铵溶液滴定至终点,反应原理为: Ti3++Fe3+=Ti4++Fe2+。
①判断滴定终点的方法:________________________ 。
②滴定终点时消耗c mol/L-1 NH4Fe(SO4)2溶液VmL,则TiO2纯度为___________(写岀相关字母表示的代数式)。
【题目】在2L密闭容器内,800℃时反应2NO(g)+O2(g)→2NO2(g)体系中,n(NO)随时间的变化如表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)上述反应_____(填“是”或“不是”)可逆反应。
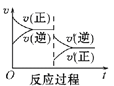
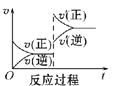
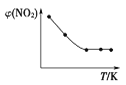
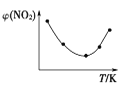
(2)如图所示,表示NO2变化曲线的是____。用O2表示0~1s内该反应的平均速率v=____。

(3)能说明该反应已达到平衡状态的是____(填字母)。
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内密度保持不变