题目内容
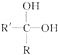
【题目】苹果酸是一种常见的有机酸,结构简式为![]() 苹果酸可能发生的反应是( )
苹果酸可能发生的反应是( )
①与NaOH溶液反应 ②与石蕊试液作用变红
③等量的苹果酸与足量的Na、NaHCO3在相同条件下生成的气体一样多
④一定条件下与乙酸酯化 ⑤一定条件下与乙醇酯化
A.①②③B.①②④⑤
C.①②③⑤D.①②③④⑤
【答案】B
【解析】
①苹果酸中含有羧基,有酸性,可与NaOH溶液反应,故①正确;②苹果酸中含有羧基,有酸性,可以与石蕊试液作用变红,故②正确;③苹果酸中含有羧基和羟基,均可以与金属钠反应放出氢气,而只有羧基与NaHCO3,等量的苹果酸与足量的Na、NaHCO3在相同条件下生成的气体物质的量比为3:4,故③错误;④苹果酸中含有羟基,一定条件下与乙酸酯化,故④正确;⑤苹果酸中含有羧基,一定条件下与乙醇酯化,故⑤正确;故选B。

【题目】某厂废酸主要含硫酸、Fe3+、Fe2+、TiO2+、Al3+ 。利用该废液制备过二硫酸铵[( NH4) 2S2O8]和TiO2的一种工艺流程如下:

已知:i.TiOSO4在热水中易水解生成H2TiO3,相关离子形成氢氧化物沉淀的pH范围如 下表:
金属离子 | TiO2+ | Fe3+ | Fe2+ | Al3+ |
开始沉淀的pH | 1.2 | 1.9 | 7.0 | 3.2 |
沉淀完全的pH | 2.8 | 3.1 | 9.4 | 4.7 |
ii. pH>7 时,Fe2+部分生成 Fe( Ⅱ)氨络离Fe(NH3)2]2+o
请回答下列问题:
(1)加入适量Fe的作用是________________ .
(2)生成TiO(OH)2的化学方程式为_______________ 。
(3)滤渣I、滤渣II均含有的物质的化学式为_____________ .
(4)加入H2O2的目的是除掉Fe( Ⅱ)氨络离子[Fe(NH3)2]2+,此过程中氧化剂与还原剂的物质的量之比理论上等于________ (填数值)。
(5)常温下,含硫微粒主要存在形式与pH的关系如下图所示。

用Pt电极电解饱和NH4HSO4溶液制备过二硫酸铵时,为满足在阳极放电的离子主要为 HSO4-,应调节阳极区溶液的pH范围在______之间,其电极反应式为____________ 。
(6)科研人员常用硫酸铁铵[NH4Fe(SO4)2]滴定法测定TiO2的纯度,其步骤为: 用足量酸溶解wg 二氧化钛样品,用铝粉做还原剂,过滤、洗涤,将滤液定容为100 mL,取 25.00 mL,以NH4SCN作指示剂,用标准硫酸铁铵溶液滴定至终点,反应原理为: Ti3++Fe3+=Ti4++Fe2+。
①判断滴定终点的方法:________________________ 。
②滴定终点时消耗c mol/L-1 NH4Fe(SO4)2溶液VmL,则TiO2纯度为___________(写岀相关字母表示的代数式)。
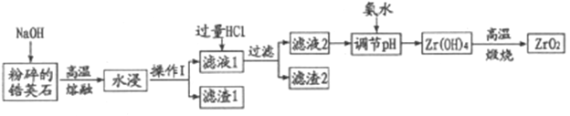
【题目】氧化材料具有高硬度、高强度、高韧性、极高的耐磨性及耐化学腐蚀性等优良的物化性能。以锆英石(主要成分为 ZrSiO4,含有少量Al2O3、SiO2、Fe2O3等杂质)为原料通过碱熔法制备氧化锆(ZrO2)的流程如下:
25℃时,有关离子在水溶液中沉淀时的pH数据:
Fe(OH)3 | Zr(OH)4 | Al(OH)3 | |
开始沉淀时pH | 1.9 | 2.2 | 3.4 |
沉淀完全时pH | 3.2 | 3.2 | 4.7 |
请回答下列问题:
(1)流程中旨在提高化学反应速率的措施有___________。
(2)操作I的名称是___________滤渣2的成分为___________。
(3)锆英石经“高温熔融”转化为Na2ZrO3,写出该反应的化学方程式:___________。
(4)“调节pH”时,合适的pH范围是___________。为了得到纯的ZrO2,Zr(OH)4需要洗涤,检验Zr(OH)4是否洗涤干净的方法是___________。
(5)写出“高温煅烧”过程的化学方程式___________。根据ZrO2的性质,推测其两种用途___________。