题目内容
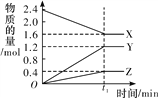
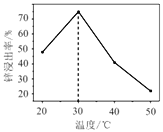
【题目】常温下,向1L 0.10mol/L的NaA溶被中,不断通入HCl气体(忽略溶液体积变化),得到c(A-)和c(HA)与pH的变化关系如下,则下列说法正确的是
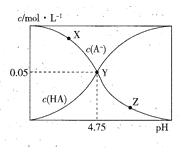
A. 水的电离程度:X<Z
B. 溶液的pH比较:X<Y<Z
C. Y点时:c(Na+)=2c(A-)>c(H+)>c(OH-)
D. 常温下、HA的Ka=104.75
【答案】C
【解析】A.NaA溶液中酸根离子水解溶液显碱性,促进水的电离,加入HCl气体,溶液碱性减弱水的电离程度减小,因此水的电离程度:X>Z,A错误;B.NaA溶液中酸根离子水解溶液显碱性,促进水的电离,加入HCl气体,溶液碱性减弱,溶液的pH:x>y>z,B错误;C.y点c(A-)=c(HA)=0.05mol/L,溶液中存在等浓度的HA和NaA,溶液显酸性,酸的电离大于酸根离子水解,根据物料守恒c(Na+)=c(HA)+c(A-)可知c(Na+)=2c(A-)>c(H+)>c(OH-),C正确;D.y点溶液中存在电离平衡HAA-+H+,此时c(A-)=c(HA),Ka= c(A-)c(H+)/c(HA)=c(H+)=10-4.75,D错误;答案选C。

 阅读快车系列答案
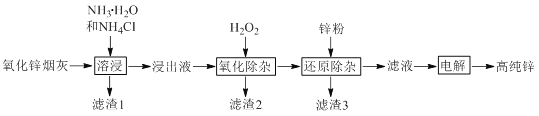
阅读快车系列答案【题目】氯化铵焙烧菱锰矿制备高纯度碳酸锰的工艺流程如下:
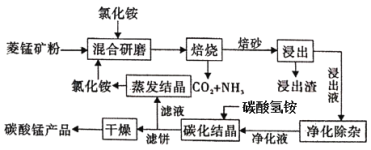
已知:①菱锰矿石主要成分是MnCO3,还含有少量Fe、Al、Ca、Mg等元素;
②常温下,CaF2、MgF2的溶度积分别为1.46×10-10、7.42×10-11
③相关金属离子c(Mn+)=0.1mol/L形成氯氧化物沉淀时的pH如下:
回答下列问题:
金属离子 | Al3+ | Fe3+ | Fe2+ | Ca2+ | Mn2+ | Mg2+ |
开始沉淀的pH | 3.8 | 1.5 | 6.3 | 10.6 | 8.8 | 9.6 |
沉淀完全的pH | 5.2 | 2.8 | 8.3 | 12.6 | 10.8 | 11.6 |
(1)“焙烧”时发生的主要化学反应方程式为______________________。
(2)分析下列图1、图2、图3,氯化铵焙烧菱镁矿的最佳条件是:
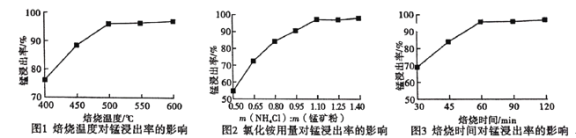
焙烧温度_________,氯化铵与菱镁矿粉的质量之比为__________,焙烧时间为___________.
(3)浸出液“净化除杂”过程如下:首先加入MnO2将Fe2+氧化为Fe3+,反应的离子方程式为________;然后调节溶液pH使Fe3+、Al3+沉淀完全,此时溶液的pH范围为____。再加入NH4F沉淀Ca2+、Mg2+,当c(Ca2+)=1.0×10-5mol/L时, c(Mg2+)=______mol/L
(4)碳化结晶时,发生反应的离子方程式为_____________________________________________。
(5)流程中能循环利用的固态物质是____________。
【题目】钇的常见化合价为+3价,我国蕴藏着丰富的含钇矿石(Y2FeBe2Si2O10),工业上通过如下生产流程可获得氧化钇。

已知:①该流程中有关金属离子形成氢氧化物沉淀时的pH见下表:
离子 | 开始沉淀时的pH | 完全沉淀时的pH |
Fe3+ | 2.1 | 3.1 |
Y3+ | 6.0 | 8.2 |
②在元素周期表中,铍元素和铝元素处于第二周期和第三周期的对角线位置,化学性质相似。
请回答下列问题:
(1)写出Na2SiO3的一种用途________________________。
(2)欲从Na2SiO3和Na2BeO2混合溶液中制得Be(OH)2沉淀。
①最好选用盐酸和________两种试剂,再通过必要的操作即可实现。
A.NaOH溶液 B.氨水 C.CO2 D.HNO3
②写出Na2BeO2与足量盐酸发生反应的离子方程式_______________________________________________。
(3)为使Fe3+沉淀完全,用氨水调节pH=a时,a应控制在_________范围内;继续加氨水调节pH=b发生反应的离子方程式为___________________________________________;
检验Fe3+是否沉淀完全的操作方法是_________________________________________。
(4)煅烧草酸钇时发生分解反应,其固体产物为氧化钇,气体产物能使澄清石灰水变浑浊。写出草酸钇[Y2(C2O4)3·nH2O]煅烧的化学方程式_____________________________________。
【题目】在2L密闭容器内,800℃时反应2NO(g)+O2(g)→2NO2(g)体系中,n(NO)随时间的变化如表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)上述反应_____(填“是”或“不是”)可逆反应。
(2)如图所示,表示NO2变化曲线的是____。用O2表示0~1s内该反应的平均速率v=____。

(3)能说明该反应已达到平衡状态的是____(填字母)。
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内密度保持不变