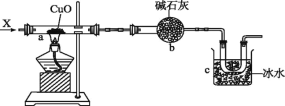
【题目】在密闭容器中进行如下化学反应CO2(g)+H2(g)CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表
t/℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
请回答下列问题:
(1)该反应的化学平衡常数表达式为:K=________________。
(2)写出一种加快该化学反应的反应速率的方法_____________________。
(3)该反应为_____________反应(填“吸热”或“放热”)。
(4)下列能说明该反应已达到化学平衡状态的是____________________。
a.容器中压强不变 b.混合气体中c(CO)不变
c.υ正(H2)=2υ逆(H2O) d .c(CO2)=c(CO)
(5)某温度下,各物质的平衡浓度符合:c(CO2)c(H2)=c(CO)c(H2O),则该反应的反应温度为_______________________℃。
【题目】
碱金属及碳族元素在科研领域、生活和生产方面有广泛的应用。回答下列问题:
(1)在元素周期表中,与Li的化学性质最相似的邻族元素是__________(填元素符号),该元素基态原子最外层电子的自旋状态___________(填“相同”或“相反”)。
(2)碳和硅的有关化学键键能如下所示:
化学键 | C-H | C-O | Si-H | Si-O |
键能/kJmol-1 | 413 | 336 | 318 | 452 |
SiH4的稳定性小于CH4,更易生成氧化物,原因是__________________。
(3)天然硅酸盐都是由[SiO4]四面体以顶角氧原子相连而成,可成链状也可成环,所以硅酸盐种类繁多。下图a代表SiO44-,b、c是硅氧四面体形成的环状结构。
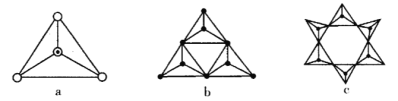
硅氧四面体中Si的轨道杂化类型为____________; 图b环状结构硅酸根的化学式为______________若在环状结构中硅的原子数为n,写出环状结构中硅酸根的通式_____________。
(4)钾与溴作用能形成溴化钾晶体,该晶体类型为___________,其晶格能可通过下图的Borm-Haber循环计算得到。

从上图可知,K原子的第一电离能为_____ kJ/mol, Br-Br键键能为______kJ/ mol,KBr的晶格能为______kJ/mol,晶格能越大,该晶体的熔点越______。