题目内容
【题目】
碱金属及碳族元素在科研领域、生活和生产方面有广泛的应用。回答下列问题:
(1)在元素周期表中,与Li的化学性质最相似的邻族元素是__________(填元素符号),该元素基态原子最外层电子的自旋状态___________(填“相同”或“相反”)。
(2)碳和硅的有关化学键键能如下所示:
化学键 | C-H | C-O | Si-H | Si-O |
键能/kJmol-1 | 413 | 336 | 318 | 452 |
SiH4的稳定性小于CH4,更易生成氧化物,原因是__________________。
(3)天然硅酸盐都是由[SiO4]四面体以顶角氧原子相连而成,可成链状也可成环,所以硅酸盐种类繁多。下图a代表SiO44-,b、c是硅氧四面体形成的环状结构。
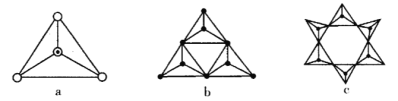
硅氧四面体中Si的轨道杂化类型为____________; 图b环状结构硅酸根的化学式为______________若在环状结构中硅的原子数为n,写出环状结构中硅酸根的通式_____________。
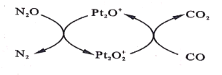
(4)钾与溴作用能形成溴化钾晶体,该晶体类型为___________,其晶格能可通过下图的Borm-Haber循环计算得到。

从上图可知,K原子的第一电离能为_____ kJ/mol, Br-Br键键能为______kJ/ mol,KBr的晶格能为______kJ/mol,晶格能越大,该晶体的熔点越______。
【答案】Mg 相反 C-H键的键能大于C-O键,C-H键比C-O键稳定.而Si-H键的键能却远小于Si-O键,所以Si-H键不稳定而倾向于形成稳定性更强的Si-O键 sp3杂化 (SiO3)36- SinO3n2n- 离子晶体 418.8 193.0 689.1 高
【解析】
(1)由对角线规格可知,Li与Mg性质相似,Mg的原子核外M层电子有2个,根据构造原理分析;
(2)键能越小,化学键越不稳定,反应倾向于形成稳定性更强方向进行;
(3)根据Si原子最外层电子数及结合的原子个数分析判断,根据b中含有的正四面体个数确定其化学式,再分析判断c,找出原子个数、电荷数目关系,得到物质是化学式通式;
(4)根据晶体构成微粒判断晶体类型,根据有关概念判断化学键的键能、晶格能大小,利用晶格能与物质熔沸点的关系判断物质熔沸点的高低。
(1)在周期表中,与Li的化学性质最相似的邻族元素是Mg,该元素是12号元素,核外电子排布是1s22s22p63s2,在同一轨道上最多容纳2个自旋方向相反的电子,所以在Mg原子基态原子核外M层电子2个电子的自旋状态相反;
(2)由表中数据可知,C-H键的键能大于C-O键,C-H键比C-O键稳定.而Si-H键的键能却远小于Si-O键,所以Si-H键不稳定而倾向于形成稳定性更强的Si-O键,所以SiH4的稳定性小于CH4,更易生成氧化物SiO2;
(3)硅氧四面体中Si原子与4个O原子形成4个σ键,无孤电子对,因此其立体构型为正四面体,Si原子轨道杂化类型为sp3杂化;
b中含有3个四面体结构,所以含有3个Si原子,含有的氧原子数为9,含有氧原子数比3个硅酸根离子少6个3,带有的电荷为:3×(-2)=-6,该离子化学式是(SiO3)36-;
c中含有6个四面体结构,所以含有6个Si原子,含有的氧原子数为18,含有氧原子数比6个硅酸根离子少6个O,带有的电荷为:6×(-2)=-12;根据图示可知:若一个单环状离子中Si原子数为n(n≥3),则含有n个四面体结构,含有的氧原子比n个硅酸根离子恰好少n个O原子,即:含有n个Si,则含有3n个O,带有的负电荷为:n×(-2)=-2n,其化学式为:SinO3n2n-;
(4)KBr晶体由K+、Br-通过离子键结合形成离子晶体;根据示意图可知K原子的第一电离能为418.8kJ/mol;![]() molBr2蒸气转化为Br气态原子吸收能量96.5kJ,则Br-Br键键能96.5kJ/mol×2=193.0kJ/mol;
molBr2蒸气转化为Br气态原子吸收能量96.5kJ,则Br-Br键键能96.5kJ/mol×2=193.0kJ/mol;
晶格能是气态离子形成1mol离子晶体释放的能量,则根据图示,结合盖斯定律可得(89.2+418.8)+(15.5+96.5-324.7)kJ/mol-QkJ/mol=-393.8kJ/mol,解得Q=+689.1kJ/mol;
离子晶体的晶格能越大,离子之间的作用力就越强,断裂消耗的能量就越大,因此该晶体的熔点越高。

【题目】纪录片《我在故宫修文物》展示了专家精湛的技艺和对传统文化的热爱与坚守,也让人体会到化学方法在文物保护中的巨大作用。
Ⅰ.某博物馆修复出土铁器的过程如下:
(1)检测锈蚀物的成分。
锈蚀物主要成分的化学式 | |||
Fe3O4 | Fe2O3·H2O | FeO(OH) | FeOCl |
FeOCl中铁元素的化合价为_______。
(2)化学修复方法:脱氯、还原,形成Fe3O4保护层。(已知:Cl-会加快铁的腐蚀)
修复过程:将铁器浸没在盛有0.5 mol·L-1 Na2SO3、0.5 mol·L-1 NaOH溶液的容器中,缓慢加热至60~90℃,一段时间后取出器物,用NaOH溶液洗涤至无Cl-。
①脱氯反应:FeOCl + OH- = FeO(OH) + Cl-。离子反应是向着离子浓度减小的方向进行的,则相同温度下,FeOCl与FeO(OH)的溶解度:s(FeOCl)______s[FeO(OH)](填>、<或=)。
②还原反应:Na2SO3还原FeO(OH)形成Fe3O4。配平化学方程式:
___Na2SO3 + ___FeO(OH) = ___Na2SO4 + ___Fe3O4 + ___H2O
③检验Cl-是否洗涤干净的方法是_______________。
Ⅱ.若要配制500mL 0.5mol·L-1的NaOH溶液用于洗涤器物,回答下列问题:
(3)配制时,应用天平称取NaOH的质量为___________(精确到小数点后两位)。
(4)某操作步骤如图所示:
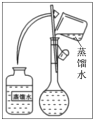
该操作应放在如图所示的____________(填序号)操作之间。
①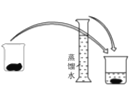 ②
②![]() ③
③![]() ④
④![]() ⑤
⑤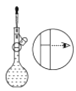 ⑥
⑥![]()
(5)下列说法错误的是_____________(填标号)。
A.称量NaOH固体的时间不宜过长
B.待烧杯中溶液冷却至室温才进行转移
C.定容时,仰视容量瓶刻度线会使配制的NaOH溶液浓度偏高
D.容量瓶可存放配好的NaOH溶液