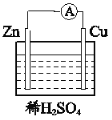
【题目】某同学在实验室研究锌与酸的反应,实验数据如下:
实验序号 | 锌质量 | 锌状态 | c(H2SO4) | V(H2SO4) | 金属消失时间 |
1 | 0.10 g | 颗粒 | 0.5mol·L-1 | 50mL | 500s |
2 | 0.10 g | 粉末 | 0.5mol·L-1 | 50mL | 50s |
3 | a g | 颗粒 | 1.0mol·L-1 | 50mL | 125s |
分析上述数据,回答下列问题
(1)实验1和2表明,_____对反应速率有影响。
(2)实验1和3研究的是反应物浓度对反应速率的影响,则a =________ g。
(3)该同学研究发现:相同的锌粒分别与H2SO4、盐酸反应(操作如下图),现象差异明显(稀盐酸中锌表面产生气泡的速率要比稀硫酸快)。

该同学对产生这一现象的原因,提出两种假设:
a. 氯离子对反应起促进作用,加快了反应的进行;
b. ________,减缓了反应的进行。
为进一步证实自己的猜想,该同学在室温下,分别取5mL 0.2 mol·L-1盐酸溶液,一份加入一定量的固体___________ (填“所加试剂化学式”),另一份作对比实验,再分别同时加入完全相同的锌粒,比较反应速率的大小。
(4)锌粒和稀硫酸反应制取氢气时,往往加入少量CuSO4粉末,可加快产生H2的速率,其原因是___ (结合化学方程式作出合理解释)。
【题目】化学反应伴随能量变化,获取反应能量变化有多条途径。
(1)下列反应中,属于吸热反应的是________(填字母)。
A.Na与水反应 B.甲烷的燃烧反应 C.CaCO3受热分解 D.锌与盐酸反应
(2)获取能量变化的途径
①通过化学键的键能计算。已知:
化学键种类 | H—H | O=O | O—H |
键能(kJ/mol) | a | b | c |
计算可得:2H2(g)+ O2(g) =2H2O(g) H=_________kJ·mol-1(用a、b、c表示)
②通过物质所含能量计算。已知反应中A+B= C+D中A、B、C、D所含能量依次可表示为EA、EB、EC、ED,该反应H=_________。
(3)已知:4g CH4完全燃烧生成CO2(g)、H2O(l)时放出热量222.5 kJ,则表示甲烷燃烧的热化学方程式为________。
(4)下图所示装置可以说明有化学能转化为电能的实验现象为__________。
【题目】称取58.7克Ba(OH)2和BaCl2固体混合物,配成500mL溶液,把该溶液分成5等份后分别加入相同浓度不同体积的NaHCO3溶液,生成沉淀的质量如下表。已知加入NaHCO3溶液体积为80.0mL时,反应后溶液呈中性。
实验序号 | Ⅰ | Ⅱ | Ⅲ | Ⅳ | Ⅴ |
NaHCO3溶液(mL) | 20.0 | 40.0 | 60.0 | 80.0 | 100.0 |
沉淀的质量(g) | 1.97 | 3.94 | 5.91 | 7.88 | 7.88 |
(1)NaHCO3溶液中溶质的物质的量浓度______________________。
(2)原固体混合物中Ba(OH)2和BaCl2的物质的量之比__________________________。