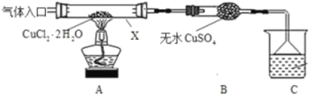
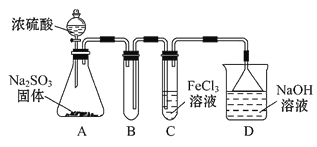
��Ŀ����
����Ŀ��ijͬѧ��ʵ�����о�п����ķ�Ӧ��ʵ����������:
ʵ����� | п���� | п״̬ | c(H2SO4) | V(H2SO4) | ������ʧʱ�� |
1 | 0.10 g | ���� | 0.5mol��L-1 | 50mL | 500s |
2 | 0.10 g | ��ĩ | 0.5mol��L-1 | 50mL | 50s |
3 | a g | ���� | 1.0mol��L-1 | 50mL | 125s |
�����������ݣ��ش���������
(1)ʵ��1��2������_____�Է�Ӧ������Ӱ�졣
(2)ʵ��1��3�о����Ƿ�Ӧ��Ũ�ȶԷ�Ӧ���ʵ�Ӱ�죬��a =________ g��
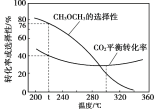
(3)��ͬѧ�о����֣���ͬ��п���ֱ���H2SO4�����ᷴӦ(��������ͼ)�������������(ϡ������п����������ݵ�����Ҫ��ϡ�����)��
��ͬѧ�Բ�����һ�����ԭ��������ּ��裺
a. �����ӶԷ�Ӧ��ٽ����ã��ӿ��˷�Ӧ�Ľ��У�
b. ________�������˷�Ӧ�Ľ��С�
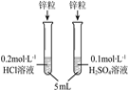
Ϊ��һ��֤ʵ�Լ��IJ��룬��ͬѧ�������£��ֱ�ȡ5mL 0.2 mol��L-1������Һ��һ�ݼ���һ�����Ĺ���___________ (���������Լ���ѧʽ��)����һ�����Ա�ʵ�飬�ٷֱ�ͬʱ������ȫ��ͬ��п�����ȽϷ�Ӧ���ʵĴ�С��
(4)п����ϡ���ᷴӦ��ȡ����ʱ��������������CuSO4��ĩ���ɼӿ����H2�����ʣ���ԭ����___ (��ϻ�ѧ����ʽ������������)��
���𰸡������������Ӵ������ 0.1 ��������ӶԷ�Ӧ���������� Na2SO4(��K2SO4��(NH4)2SO4) Zn+ CuSO4= Cu+ ZnSO4 ��ͭ��п��ϡ���ṹ��ԭ��أ��ӿ췴Ӧ����
��������
(1)���ݿ��Ʊ�������ʵ��1��2ֻ��п״̬��ͬ��˵�����������Է�Ӧ������Ӱ�죻
(2)ʵ��1��3�о����Ƿ�Ӧ��Ũ�ȶԷ�Ӧ���ʵ�Ӱ�죬���ݿ��Ʊ�������ֻ���������Ũ�Ȳ�ͬ��п������п״̬Ӧ��ͬ������a =0.1g��
(3)����ʵ�飬п��״̬��������ͬ��������Ũ����ͬ��ֻ�������ͬ�����Է�Ӧ���ʲ�ͬ��ԭ������ǣ�a. �����ӶԷ�Ӧ��ٽ����ã��ӿ��˷�Ӧ�Ľ��У� b. ��������ӶԷ�Ӧ���������ã������˷�Ӧ�Ľ��С�
ȡ����5mL 0.2 mol��L-1������Һ��һ�ݼ���һ�����Ĺ��������ƣ���һ�����Ա�ʵ�飬�ٷֱ�ͬʱ������ȫ��ͬ��п�����ȽϷ�Ӧ���ʵĴ�С�������������Ƶ������п��Ӧ����������˵����������ӶԷ�Ӧ���������á�
(4)п����ϡ���ᷴӦ��ȡ����ʱ����������CuSO4��ĩ��������Ӧ��Zn+ CuSO4= Cu+ ZnSO4 �����ɵ�ͭ��п��ϡ���ṹ��ԭ��أ���Ӧ���ʼӿ졣

����Ŀ��������(NiSO4)��һ����Ҫ�Ļ���ԭ�ϣ��㷺Ӧ���ڵ�ơ�ҽҩ��ӡȾ�ȹ�ҵ���Ժ����ϴ���(��Ҫ��Ni��������Al��Al2O3��Fe�������������ᡢ�������)Ϊԭ������NiSO4��7H2O��������ֹ����������£�
����һ��
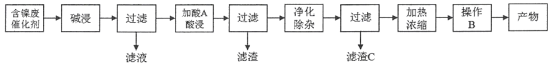
���̶���
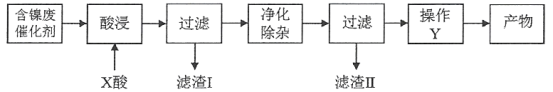
��֪�����ֽ������������Ksp����ֵ���±���ʾ��
��ѧʽ | Fe(OH)2 | Fe(OH)3 | Al(OH)3 | Ni(OH)2 |
Ksp����ֵ | 10��17 | 10��39 | 10��34 | 10��15 |
�ش��������⣺
(1)����һ��������A�����̶���������X___________(������ͬ����������ͬ��)������һ������C�����̶�������II___________(������ͬ����������ͬ��)�����̶�������I��___________��
(2)����һ���������ʱ������Ӧ�����ӷ���ʽΪ_________________��___________________��
(3)���̶��������������������������������̣���һ��������������H2O2��������Ӧ�����ӷ���ʽ��____________________________________________���ڶ�����������Һ��pH��
(4)�����Ƚ�����һ�в���B�����̶��в���Y�ش����Y��___________��___________�����ˡ�ϴ�ӡ�������ò��
(5)�ɼ�֪��Ϣ��ʽ���㣺�����£�Ni2����ȫ����ʱ��pHֵ___________��