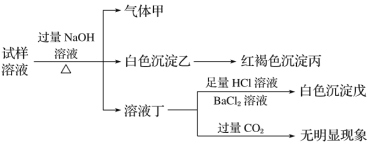
题目内容
【题目】25℃时,取浓度均为0.1mol·L-1的醋酸溶液和氨水溶液各20 mL,分别用0.1mol·L-1NaOH溶液、0.1 mol·L-1盐酸进行中和滴定,滴定过程中pH随滴加溶液的体积变化关系如图所示。

下列说法正确的是
A.曲线I中滴加溶液到10 mL时:c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
B.曲线I中滴加溶液到25 mL时:c(NH4+)>c(C1-)>c(H+)>c(OH-)
C.曲线II中滴加溶液在10 mL~25 mL之间存在:c(NH4+)=c(Cl-)>c(OH-)=c(H+)
D.曲线II中滴加溶液到10mL时:c(CH3COO-)-c(CH3COOH)=2[c(H+)-c(OH-)]
【答案】D
【解析】
A.曲线I滴定前溶液的pH大于7,为盐酸滴定氨水,当滴加溶液到10 mL时,溶液中含有等浓度的NH3H2O和NH4Cl,不含CH3COO,A错误;
B.曲线I中滴加溶液到25 mL时,溶液含NH4Cl和少量的HCl,离子浓度大小顺序为:c(C1-) > c(NH4+)>c(H+)>c(OH-),B错误;
C.曲线II滴定前溶液的pH小于7,为NaOH溶液滴定醋酸,溶液不存在NH4+和Cl,C错误;
D.曲线II中滴加溶液到10mL时,溶液含有等浓度的CH3COOH和CH3COONa,根据电荷守恒可得:c(CH3COO)+c(OH)=c(Na+)+c(H+),根据物料守恒可得:c(CH3COOH)+c(CH3COO)=2c(Na+),①式×2—②式可得:c(CH3COO-)-c(CH3COOH)=2[c(H+)-c(OH-)],D正确;
故答案选D。

 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案【题目】某同学在实验室研究锌与酸的反应,实验数据如下:
实验序号 | 锌质量 | 锌状态 | c(H2SO4) | V(H2SO4) | 金属消失时间 |
1 | 0.10 g | 颗粒 | 0.5mol·L-1 | 50mL | 500s |
2 | 0.10 g | 粉末 | 0.5mol·L-1 | 50mL | 50s |
3 | a g | 颗粒 | 1.0mol·L-1 | 50mL | 125s |
分析上述数据,回答下列问题
(1)实验1和2表明,_____对反应速率有影响。
(2)实验1和3研究的是反应物浓度对反应速率的影响,则a =________ g。
(3)该同学研究发现:相同的锌粒分别与H2SO4、盐酸反应(操作如下图),现象差异明显(稀盐酸中锌表面产生气泡的速率要比稀硫酸快)。

该同学对产生这一现象的原因,提出两种假设:
a. 氯离子对反应起促进作用,加快了反应的进行;
b. ________,减缓了反应的进行。
为进一步证实自己的猜想,该同学在室温下,分别取5mL 0.2 mol·L-1盐酸溶液,一份加入一定量的固体___________ (填“所加试剂化学式”),另一份作对比实验,再分别同时加入完全相同的锌粒,比较反应速率的大小。
(4)锌粒和稀硫酸反应制取氢气时,往往加入少量CuSO4粉末,可加快产生H2的速率,其原因是___ (结合化学方程式作出合理解释)。