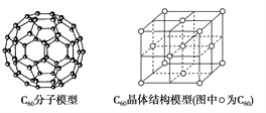
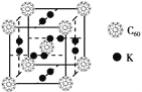
【题目】NiCl2是化工合成中最重要的镍源,在实验室中模拟工业上以金属镍废料(含Fe、Al等杂质)为原料生产NiCl2的工艺流程如下:

下表列出了相关金属离子生成氢氧化物沉淀的pH
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | Ni(OH)2 |
开始沉淀的pH | 2.1 | 6.5 | 3.7 | 7.1 |
沉淀完全的pH | 3.3 | 9.7 | 4.7 | 9.2 |
(1)为了提高镍元素的浸出率,在“酸浸”时可采取的措施有__________(写一条即可)。
(2)加入H2O2时发生主要反应的离子方程式为__________。
(3)“调pH”时,控制溶液pH的范围为__________。
(4)“沉镍”过程中,若滤液A中c(Ni2+)=1.0mol/L,欲使100mL该滤液中的Ni2+沉淀完全[即溶液中c(Ni2+)≤1.0×10-5],则需用托盘天平称取Na2CO3固体的质量至少为_____g。(已知Ksp(NiCO3)=6.5×10-6,忽略溶液体积的变化)
(5)流程中由溶液得到NiCl2·6H2O的实验操作步骤依次为______、过滤、洗涤、干燥。
【题目】利用化学原理可以对工厂排放的废水、废渣等进行有效检测与合理处理。某工厂对制革工业污泥中Cr(Ⅲ)的处理工艺流程如下:
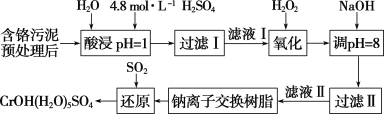
已知:酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+等。
(1)配制500mL4.8mol/L的稀硫酸溶液,需要的玻璃仪器除烧杯、玻璃棒外,还需要______。
(2)酸浸时,为了提高浸取率可采取的措施有________、________。(答出两点)
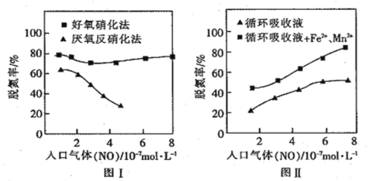
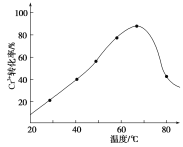
(3)H2O2的作用是将滤液Ⅰ中的Cr3+转化为Cr2O![]() ,则此反应中氧化剂和还原剂的物质的量之比为________。控制其他条件不变,反应温度对Cr3+转化率的影响如图所示。请分析温度超过70 ℃时,Cr3+转化率下降的原因是__________。
,则此反应中氧化剂和还原剂的物质的量之比为________。控制其他条件不变,反应温度对Cr3+转化率的影响如图所示。请分析温度超过70 ℃时,Cr3+转化率下降的原因是__________。
(4)常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下:
阳离子 | Fe3+ | Al3+ | Cr3+ |
开始沉淀时的pH | 2.7 | — | — |
沉淀完全时的pH | 3.7 | 5.4(>8溶解) | 9(>9溶解) |
①用NaOH调节溶液的pH不能超过8,其理由是_________。
②当pH=8时,Mg2+是否开始沉淀(溶液中镁离子浓度约为1 mol·L-1)________(填 “是”或“否”)。已知Ksp[Mg(OH)2]=1.8×10-11。
(5)上述流程中,加入NaOH溶液后,溶液呈碱性,Cr2O72-转化为CrO42-,写出上述流程中用SO2进行还原反应生成CrOH(H2O)5SO4沉淀的离子方程式 _________。
(6)Cr(OH)3和Al(OH)3类似,也是两性氢氧化物,写出向CrCl3溶液中逐滴加NaOH溶液至过量的离子方程式_____________。
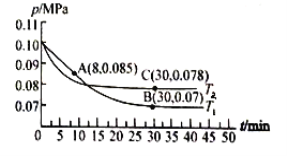
【题目】在![]() 密闭容器内,800℃时在反应
密闭容器内,800℃时在反应![]() 体系中,
体系中,![]() 随时间的变化如表所示:
随时间的变化如表所示:
时间/ | 0 | 1 | 2 | 3 | 4 | 5 |
| 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
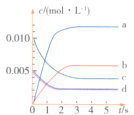
(1)下图表示![]() 的变化的曲线是________。用
的变化的曲线是________。用![]() 表示
表示![]() 内该反应的平均速率
内该反应的平均速率![]() ________。
________。
(2)能说明该反应已达到平衡状态的有________(填序号,下同)。
a ![]() b 容器内压强保持不变
b 容器内压强保持不变
c ![]() d 容器内密度保持不变
d 容器内密度保持不变
(3)为使该反应的反应速率增大,下列措施正确的有________。
a 适当升高温度 b 增大![]() 的浓度 c 选择高效催化剂解粉
的浓度 c 选择高效催化剂解粉
【题目】700 ℃时,向容积为2 L的密闭容器中充入一定量的CO和H2O,发生反应:CO(g)+H2O(g) CO2(g)+H2(g),反应过程中测定的部分数据见下表(表中t2>t1):
反应时间/min | n(CO)/mol | n(H2O)/mol |
0 | 1.20 | 0.60 |
t1 | 0.20 | |
t2 | 0.80 |
依据题意回答下列问题:
(1)反应在t1 min内的平均速率为v(H2)=________ mol·L-1·min-1。
(2)保持其他条件不变,起始时向容器中充入0.60 mol CO和1.20 mol H2O,到达平衡时,n(CO2)=________mol。
(3)温度升至800 ℃,上述反应的平衡常数为0.64,则正反应为________反应(填“放热”或“吸热”)。
(4)700 ℃时,向容积为2 L的密闭容器中充入CO(g)、H2O(g)、CO2(g)、H2(g)的物质的量分别为1.20 mol、2.00 mol、1.20 mol、1.20 mol,则此时该反应v(正)________v(逆)(填“>”“<”或“=”)。
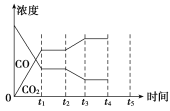
(5)该反应在t1时刻达到平衡,在t2时刻因改变某个条件,CO和CO2浓度发生变化的情况如图所示。图中t2时刻发生改变的条件可能是________或________。
(6)若该容器容积不变,能说明反应达到平衡的是________。
①c(CO)与c(H2)的比值保持不变
②v(CO2)正=v(H2O)逆
③体系的压强不再发生变化
④混合气体的密度不变
⑤体系的温度不再发生变化
⑥气体的平均相对分子质量不变