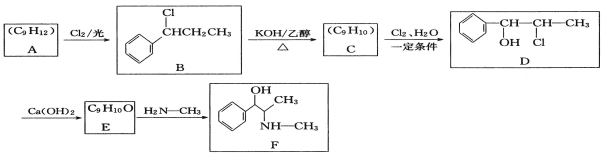
题目内容
【题目】如图表示一些晶体中的某些结构,请回答下列问题:

(1)代表金刚石的是(填编号字母,下同)___,其中每个碳原子与____个碳原子最近且距离相等。金刚石属于____晶体。
(2)代表石墨的是____,每个正六边形占有的碳原子数平均为____个。
(3)代表NaCl的是___,每个Na+周围与它最近且距离相等的Na+有___个。
(4)代表CsCl的是___,它属于____晶体,每个Cs+与____个Cl-紧邻。
(5)代表干冰的是___,它属于___晶体,每个CO2分子与___个CO2分子紧邻。
(6)已知石墨中碳碳键的键长比金刚石中碳碳键的键长短,则上述五种物质熔点由高到低的排列顺序为____。
【答案】D 4 原子 E 2 A 12 C 离子 8 B 分子 12 石墨>金刚石>NaCl>CsCl>干冰
【解析】
(1)在金刚石晶胞中,每个碳原子连接4个碳原子,原子间以共价键相结合,将这4个碳原子连接后形成四面体,体心有一个碳原子,因此D为金刚石,每个原子与4个碳原子最近且距离相等,金刚石是空间网状结构,属于原子晶体;
(2)石墨是层状结构,在层与层之间以范德华力相互作用,在层内碳与碳之间以共价键相互作用,形成六边形,因此E为石墨的结构,每个正六边形的碳原子数平均为6×![]() =2;
=2;
(3)在NaCl晶胞中,每个Na+周围有6个Cl-,每个Cl-周围也有6个Na+,所以A图为NaCl的结构;根据晶胞的结构,每个Na+周围距离最近的Na+在小立方体的面对角线上,每个Na+周围有8个这样的立方体,所以,每个Na+周围与它距离相等的Na+有12个;
(4)CsCl的晶胞中Cs+和Cl-的配位数都是8,即每个Cs+周围有8个Cl-,每个Cl-的周围也有8个Cs+,所以C图为CsCl的晶胞,属于离子晶体;
(5)干冰属于分子晶体,CO2位于立方体的顶点和面心上,以顶点上的CO2为例,与它距离最近的CO2位于与该顶点相连的12个面的面心上,因此B图为干冰晶体;
(6)熔点:原子晶体>离子晶体>分子晶体,石墨的熔点大于金刚石,在离子晶体中,半径越大,晶格能越小,熔点越低,由于Cs+半径大于Na+,因此熔点由高到低的顺序为:石墨>金刚石>NaCl>CsCl>干冰。

【题目】利用化学原理可以对工厂排放的废水、废渣等进行有效检测与合理处理。某工厂对制革工业污泥中Cr(Ⅲ)的处理工艺流程如下:
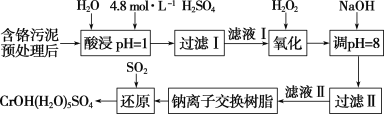
已知:酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+等。
(1)配制500mL4.8mol/L的稀硫酸溶液,需要的玻璃仪器除烧杯、玻璃棒外,还需要______。
(2)酸浸时,为了提高浸取率可采取的措施有________、________。(答出两点)
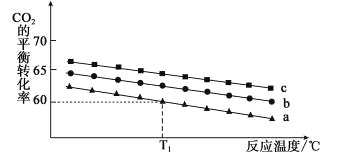
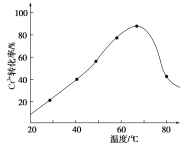
(3)H2O2的作用是将滤液Ⅰ中的Cr3+转化为Cr2O![]() ,则此反应中氧化剂和还原剂的物质的量之比为________。控制其他条件不变,反应温度对Cr3+转化率的影响如图所示。请分析温度超过70 ℃时,Cr3+转化率下降的原因是__________。
,则此反应中氧化剂和还原剂的物质的量之比为________。控制其他条件不变,反应温度对Cr3+转化率的影响如图所示。请分析温度超过70 ℃时,Cr3+转化率下降的原因是__________。
(4)常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下:
阳离子 | Fe3+ | Al3+ | Cr3+ |
开始沉淀时的pH | 2.7 | — | — |
沉淀完全时的pH | 3.7 | 5.4(>8溶解) | 9(>9溶解) |
①用NaOH调节溶液的pH不能超过8,其理由是_________。
②当pH=8时,Mg2+是否开始沉淀(溶液中镁离子浓度约为1 mol·L-1)________(填 “是”或“否”)。已知Ksp[Mg(OH)2]=1.8×10-11。
(5)上述流程中,加入NaOH溶液后,溶液呈碱性,Cr2O72-转化为CrO42-,写出上述流程中用SO2进行还原反应生成CrOH(H2O)5SO4沉淀的离子方程式 _________。
(6)Cr(OH)3和Al(OH)3类似,也是两性氢氧化物,写出向CrCl3溶液中逐滴加NaOH溶液至过量的离子方程式_____________。