题目内容
【题目】近几年我国大面积发生雾霾天气,其主要原因是SO2、NOx等挥发性有机物等发生二次转化,研究碳、氮、硫及其化合物的转化对于环境的改善有重大意义。
(1)在一定条件下,CH4可与NOx反应除去NOx,已知有下列热化学方程式:
①CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890.3 kJ·mol-1
②N2(g)+2O2(g)![]() 2NO2(g) △H=+67.0 kJ·mol-1
2NO2(g) △H=+67.0 kJ·mol-1
③H2O(g)=H2O(l) △H=-41.0 kJ·mol-1
则CH4(g)+2NO2(g) ![]() CO2(g)+2H2O(g)+N2 (g) △H=____kJ·mol-1;该反应在________(高温,低温,任何温度)下可自发进行
CO2(g)+2H2O(g)+N2 (g) △H=____kJ·mol-1;该反应在________(高温,低温,任何温度)下可自发进行
(2)若在T1℃、0.1 MPa条件下,往一密闭容器通入SO2和O2 [其中n(SO2):n(O2)= 2:1],测得容器内总压强与反应时间如下图所示。
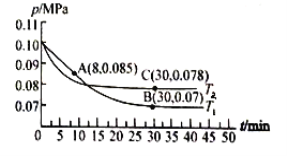
①图中A点时,SO2的转化率为________。
②在其他条件不变的情况下,测得T2℃时压强的变化曲线如图所示,则C点的正反应速率![]() 0(正)与A点的逆反应速率
0(正)与A点的逆反应速率![]() A(逆)的大小关系为
A(逆)的大小关系为![]() 0(正)_____
0(正)_____![]() A(逆) (填“>"、“<”或“ = ”)。
A(逆) (填“>"、“<”或“ = ”)。
③图中B点的平衡常数Kp=__________(MPa)-1。(Kp=压强平衡常数,用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
(3)利用脱氮菌可净化低浓度NO废气。当废气在塔内停留时间均为 90s 的情况下,测得不同条件下 NO 的脱氮率如图Ⅰ、Ⅱ所示。
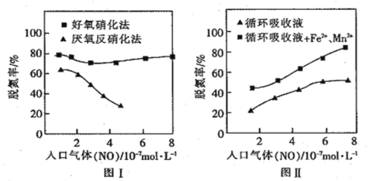
①由图I知,当废气中的NO含量增加时,宜选用______________法提高脱氮效率。
②图Ⅱ中,循环吸收液加入Fe2+、Mn2+提高了脱氮的效率,其可能原因为______________。
【答案】-875.3 任何温度下 45% > 24300(MPa)-1 好氧硝化 Fe2+、Mn2+对该反应有催化作用
【解析】
(1)根据盖斯定律求焓变;
(2)列三段式求解转化率和平衡常数;
(3)根据图像分析,得出结论。
(1)根据盖斯定律,![]() 得到目标方程式:
得到目标方程式: ![]() ,故焓变为:
,故焓变为:![]() ,跟据方程式,反应气体增多,所以该反应为熵增反应,
,跟据方程式,反应气体增多,所以该反应为熵增反应,![]() ,故该反应任何温度下都能自发进行,
,故该反应任何温度下都能自发进行,
答案为:-875.3;任何温度下;
(2)①依据化学三段列式计算,设氧气消耗物质的量为x, 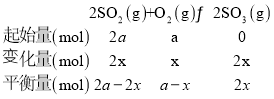 图中A点时,气体总压强0.085,则
图中A点时,气体总压强0.085,则![]() ,得x=0.45a,故SO2的转化率
,得x=0.45a,故SO2的转化率![]() ,
,
故答案为:45%;
②图象分析可知,先拐先平温度高则T1<T2,C点是平衡状态,A点反应未达到平衡状态,其中C点的正反应速率vC(正)与A点的逆反应速率vA(逆)的大小关系为vC(正)>vA(逆)
故答案为:>;
③图中B点,依据化学三行列式计算,设氧气消耗物质的量为y,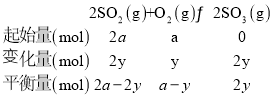 ,B点气体总压强为0.007,则
,B点气体总压强为0.007,则![]() ,y=0.9a,平衡常数
,y=0.9a,平衡常数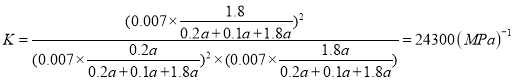 ,故答案为:24300(MPa)1;
,故答案为:24300(MPa)1;
(3)①根据图I可知,当![]() 浓度大的时候,好氧硝化法脱氮率更高,
浓度大的时候,好氧硝化法脱氮率更高,
故答案为:好氧硝化;
②根据图Ⅱ,循环吸收液加入![]() 提高了脱氮的效率,故
提高了脱氮的效率,故![]() 可能是起到了催化作用,
可能是起到了催化作用,
答案为:![]() 对该反应有催化作用。
对该反应有催化作用。

 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案【题目】在3种不同条件下,分别向容积为2L的恒容密闭容器中充入2molA和1molB,发生反应:2A(g)+B(g)![]() 2C(g) ΔH=QkJ/mol。相关条件和数据见下表:
2C(g) ΔH=QkJ/mol。相关条件和数据见下表:
实验编号 | 实验Ⅰ | 实验Ⅱ | 实验Ⅲ |
反应温度/℃ | 700 | 700 | 750 |
达平衡时间/min | 40 | 5 | 30 |
平衡时n(C)/mol | 1.5 | 1.5 | 1 |
化学平衡常数 | K1 | K2 | K3 |
下列说法正确的是( )
A.K1=K2<K3
B.升高温度能加快反应速率的原因是降低了反应的活化能
C.实验Ⅱ比实验Ⅰ达平衡所需时间小的可能原因是使用了催化剂
D.实验Ⅲ达平衡后,恒温下再向容器中通入1molA和1molC,平衡正向移动