��Ŀ����
����Ŀ�����û�ѧԭ�����ԶԹ����ŷŵķ�ˮ�������Ƚ�����Ч��������������ij�������Ƹ﹤ҵ������Cr(��)�Ĵ��������������£�
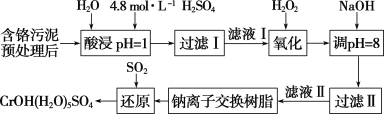
��֪�����ȡҺ�еĽ���������Ҫ��Cr3���������Fe3����Al3����Ca2����Mg2���ȡ�
��1������500mL4.8mol/L��ϡ������Һ����Ҫ�IJ����������ձ����������⣬����Ҫ______��
��2�����ʱ��Ϊ����߽�ȡ�ʿɲ�ȡ�Ĵ�ʩ��________��________��(�������)
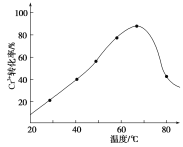
��3��H2O2�������ǽ���Һ���е�Cr3��ת��ΪCr2O![]() ����˷�Ӧ���������ͻ�ԭ�������ʵ���֮��Ϊ________�����������������䣬��Ӧ�¶ȶ�Cr3��ת���ʵ�Ӱ����ͼ��ʾ��������¶ȳ���70 ��ʱ��Cr3��ת�����½���ԭ����__________��
����˷�Ӧ���������ͻ�ԭ�������ʵ���֮��Ϊ________�����������������䣬��Ӧ�¶ȶ�Cr3��ת���ʵ�Ӱ����ͼ��ʾ��������¶ȳ���70 ��ʱ��Cr3��ת�����½���ԭ����__________��
��4�������£�����������������������ʽ����ʱ��Һ��pH���£�
������ | Fe3�� | Al3�� | Cr3�� |
��ʼ����ʱ��pH | 2.7 | �� | �� |
������ȫʱ��pH | 3.7 | 5.4(��8�ܽ�) | 9(��9�ܽ�) |
����NaOH������Һ��pH���ܳ���8����������_________��
�ڵ�pH��8ʱ��Mg2���Ƿ�ʼ����(��Һ��þ����Ũ��ԼΪ1 mol��L��1)________(�� ��������������)����֪Ksp[Mg(OH)2]��1.8��10��11��
��5�����������У�����NaOH��Һ����Һ�ʼ��ԣ�Cr2O72-ת��ΪCrO42-��д��������������SO2���л�ԭ��Ӧ����CrOH(H2O)5SO4���������ӷ���ʽ _________��
��6��Cr(OH)3��Al(OH)3���ƣ�Ҳ�������������д����CrCl3��Һ����μ�NaOH��Һ�����������ӷ���ʽ_____________��
���𰸡�500moL����ƿ������ι� �ʵ������¶�(����) ���� 3��2 ˫��ˮ�ڽϸ��¶��·����ֽ⣬Ũ�Ƚ��� pH����8��ʹ����Al(OH)3�ܽ�����AlO2-������Ӱ��Cr������������ �� 3SO2��2CrO42-��12H2O=2CrOH(H2O)5SO4����SO42-��2OH�� Cr3+��3OH�� = Cr(OH)3��
Cr(OH)3��OH��= [Cr(OH)4]�� �ۻ�Cr(OH)3��OH��= CrO2����2H2O��
��������
��������Ԥ�������������ȡҺ�н���������Ҫ��Cr3+�������Fe3+��Al3+��Ca2+��Mg2+�����������������������Ϊ��̬����������������Һ������ҺpH=8ʹ�������ӳ��������˵õ���Һ�������ӽ�����֬����þ���Ӻ����ӣ��õ� ��Һ��ͨ���������ԭ�õ�CrOH(H2O)5SO4���ݴ˷�����
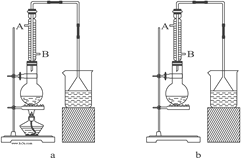
��1������һ�����ʵ���Ũ�ȵ���Һ����IJ��������У��ձ����������������ܡ�����ƿ�ͽ�ͷ�ιܣ��ʴ�Ϊ��500mL����ƿ����ͷ�ιܣ�
��2�����ʱ��Ϊ����߽�ȡ�ʿɲ�ȡ�Ĵ�ʩ�ǣ��ʵ������¶�(����)�����裻
��3��˫��ˮ��ǿ�����ԣ���������ԭ�Ե����ʣ�Cr3+�л�ԭ�ԣ�Cr3+�ܱ�˫��ˮ����Ϊ�����ӣ��Ա������������ӷ��룬��Ӧ�����ӷ���Ϊ��2Cr3++3H2O2+H2O=Cr2O72-+8H+����Ӧ���������ͻ�ԭ�������ʵ���֮��Ϊ3��2��
�¶����߳���70��ʱ��������ֽ⣬ʹƽ��������У�Cr������ת�����½����ʴ�Ϊ���ϸ��¶���˫��ˮ�ֽ⣻
��4���ٳ���pH=8��������������������������ܽ���ǿ����Һ��Ӱ������ӵĻ������ã������ӽ�����֬�����������Ǹ����Ӻ�þ���ӣ�
�ڵ�pH=8ʱ��c(Mg2+)c2(OH-)=(Ksp[Mg(OH)2]=1. 8��10-11��c(Mg2+)=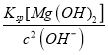 =
=![]() =18mol/L, ��Һ��þ����Ũ�Ȳ�����1mol��L-1����ˣ���ʱMg2+��������
=18mol/L, ��Һ��þ����Ũ�Ȳ�����1mol��L-1����ˣ���ʱMg2+��������
��5���������̿�֪����SO2���л�ԭCrO42-��������Ӧ����CrOH(H2O)5SO4���������ӷ���ʽΪ3SO2��2CrO42-��12H2O=2CrOH(H2O)5SO4����SO42-��2OH����
��6��Cr(OH)3��Al(OH)3���ƣ�Ҳ���������������CrCl3��Һ����μ�NaOH��Һ�����������ӷ���ʽΪCr3+��3OH�� = Cr(OH)3����Cr(OH)3��OH��= [Cr(OH)4]�� �ۻ�Cr(OH)3��OH��= CrO2����2H2O�ݡ�

����Ŀ��Cl2��Ư��Һ(��Ч�ɷ�Ϊ NaClO)�������������й㷺����ɱ����������
(1)��� NaCl ��Һ����Cl2�Ļ�ѧ����ʽ��________________��
(2)Cl2����H2O��NaOH ��Һ�������ˮ��Ư��Һ��
�ٸ������������Ư�����ʣ�����ˮȴ��Ư�����ã�˵����Ư�����õ�������_____��
��25����Cl2��H2O��NaOH �ķ�Ӧ���£�
��Ӧ�� | Cl2+H2O |
��Ӧ�� | Cl2+2OH- |
���Ͳ�ֱ��ʹ����ˮ��ʹ��Ư��Һ����������ԭ��_____��
(3)��ͥʹ��Ư��Һʱ������ֱ�ӽӴ�����Ʒ��Ư��Һ��ʴ���ĵ缫��ӦΪ��Fe-2e-=Fe2+��ClO-�����ĵ缫��ӦʽΪ____________��
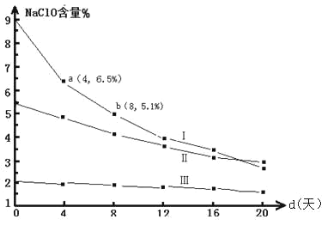
(4)�о�Ư��Һ���ȶ��Զ��������ͱ�����ʵ�����塣30��ʱ��pH=11 ��Ư��Һ��NaClO �������ٷֺ�����ʱ��仯���£�
�ȽϷֽ����� v(I)�� v(II)�Ĵ�С��ϵ_____��ԭ����_____��