题目内容
【题目】700 ℃时,向容积为2 L的密闭容器中充入一定量的CO和H2O,发生反应:CO(g)+H2O(g) CO2(g)+H2(g),反应过程中测定的部分数据见下表(表中t2>t1):
反应时间/min | n(CO)/mol | n(H2O)/mol |
0 | 1.20 | 0.60 |
t1 | 0.20 | |
t2 | 0.80 |
依据题意回答下列问题:
(1)反应在t1 min内的平均速率为v(H2)=________ mol·L-1·min-1。
(2)保持其他条件不变,起始时向容器中充入0.60 mol CO和1.20 mol H2O,到达平衡时,n(CO2)=________mol。
(3)温度升至800 ℃,上述反应的平衡常数为0.64,则正反应为________反应(填“放热”或“吸热”)。
(4)700 ℃时,向容积为2 L的密闭容器中充入CO(g)、H2O(g)、CO2(g)、H2(g)的物质的量分别为1.20 mol、2.00 mol、1.20 mol、1.20 mol,则此时该反应v(正)________v(逆)(填“>”“<”或“=”)。
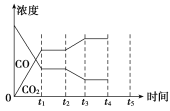
(5)该反应在t1时刻达到平衡,在t2时刻因改变某个条件,CO和CO2浓度发生变化的情况如图所示。图中t2时刻发生改变的条件可能是________或________。
(6)若该容器容积不变,能说明反应达到平衡的是________。
①c(CO)与c(H2)的比值保持不变
②v(CO2)正=v(H2O)逆
③体系的压强不再发生变化
④混合气体的密度不变
⑤体系的温度不再发生变化
⑥气体的平均相对分子质量不变
【答案】![]() 0.40 放热 > 降温 增大c(H2O)或减小c(H2) ①②⑤
0.40 放热 > 降温 增大c(H2O)或减小c(H2) ①②⑤
【解析】
(1)根据v=![]() 计算反应速率;
计算反应速率;
(2)根据反应时转化的物质的量计算n(CO2);
(3)根据温度变化对平衡常数的影响判断反应热;
(4)据K和Qc的大小比较判断;
(5)据图可知,CO浓度继续减小和二氧化碳的浓度继续增大,在t2时刻平衡正向移动,可能是增加水蒸汽的量或减少氢气的量或降温;
(6)不传热的固定容积的容器中,反应达到平衡的标志是正逆反应速率相同,各成分含量保持不变分析判断选项。
(1) CO(g)+H2O(g) CO2(g)+H2(g),根据方程式,t1 min内消耗水0.4 mol,生成氢气0.4 mol,反应在t1 min内的平均速率v(H2)=![]() =
=![]() mol·L-1·min-1,故答案为:
mol·L-1·min-1,故答案为:![]() ;
;
(2)由以上数据可知,t2时n(H2O)=0.2mol,转化H2O的物质的量为0.4mol,转化的H2也为0.4mol,t2时n(H2)=0.4mol,与t1时相同,说明t1时达到达到平衡状态,根据化学方程式可知,则生成的n(CO2)=0.4mol,故答案为:0.4;
(3)由题给数据建立如下三段式:
CO(g)+H2O(g) ![]() CO2(g)+H2(g)
CO2(g)+H2(g)
起始:1.2mol0.6mol 0 0
转化:0.4mol0.4mol 0.4mol0.4mol
平衡:0.8mol0.2mol 0.4mol0.4mol
t1时达到达到平衡状态,平衡常数K=![]() =
=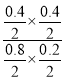 ,则K=
,则K=![]() =1,温度升至800 ℃,上述反应的平衡常数为0.64,平衡常数减小,说明升高温度平衡向逆反应方向移动,则正反应放热,即△H<0,故答案为:放热;
=1,温度升至800 ℃,上述反应的平衡常数为0.64,平衡常数减小,说明升高温度平衡向逆反应方向移动,则正反应放热,即△H<0,故答案为:放热;
(4) 700 ℃时,向容积为2 L的密闭容器中充入CO(g)、H2O(g)、CO2(g)、H2(g)浓度熵Qc=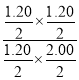 =
=![]() =0.6<1,平衡正向移动,v(正)>v(逆),故答案为:>;
=0.6<1,平衡正向移动,v(正)>v(逆),故答案为:>;
(5)该反应在t1时刻达到平衡,在t2时刻c(CO2)逐渐增大,c(CO)逐渐减小,说明平衡正向移动,改变条件可能是降温、增大c(H2O)或减小c(H2),
答案为:降温;增大c(H2O)或减小c(H2);
(6)①CO是反应物,H2是生成物,c(CO)与c(H2)的比值保持不变,一定达到平衡状态,故①正确;
②v(CO2)正=v(H2O)逆,正、逆反应速率相同,一定达到平衡状态,故②正确;
③由于反应前后气体的物质的量不变,则体系的压强是一恒量,压强不变反应不一定平衡状态,故③错误;
④根据ρ=![]() ,密度为恒量,混合气体的密度不变不一定平衡状态,故④错误;
,密度为恒量,混合气体的密度不变不一定平衡状态,故④错误;
⑤该反应放热,体系的温度不再发生变化,一定达到平衡状态,故⑤正确;
⑥根据M=![]() ,平均相对分子质量为恒量,气体的平均相对分子质量不变,不一定平衡状态,故⑥错误;
,平均相对分子质量为恒量,气体的平均相对分子质量不变,不一定平衡状态,故⑥错误;
①②⑤正确,故答案为:①②⑤。

【题目】某兴趣小组探究溶液的 pH 对 KI 与 O2 反应的影响,实验如下。
装置 | 烧杯中的液体 | 现象 |
| ① 2 mL 1 mol/L KI 溶液+5 滴淀粉 | 5 分钟后无明显变化 |
② 2 mL 1 mol/L KI 溶液+5 滴淀粉+2 mL 0.2 mol/L HCl 溶液 | 5 分钟后溶液变蓝 | |
③ 2 mL 1 mol/L KI 溶液+5 滴淀粉+2 mL 0.2 mol/L KCl 溶液 | 5 分钟后无明显变化 | |
④ 2 mL pH=8.5 混有 KOH 的 1 mol/L KI 溶液+5 滴淀粉 | 5 小时后溶液才略变蓝 | |
⑤ 2 mL pH=10混有KOH的1 mol/L KI 溶液+5 滴淀粉 | 5 小时后无明显变化 |
(1)实验①中无现象,可能的原因是:i.KI与O2不反应,ii._____。
(2)若放置5小时后,实验①中的溶液变蓝,则反应的离子方程式是_____。
(3)去掉实验③,对该探究过程_____(填“有”或“没有”)影响。
(4)对比实验②和实验④,可以得出的结论是_____。
(5)对于实验⑤的现象,甲同学提出猜想“pH=10时O2不能氧化 I-”,设计了下列装置进行实验⑥,验证猜想。

i.烧杯a 中的溶液为_____。
ii. 实验结果是b 中溶液变蓝,此猜想不成立。通入O2后,a中的电极反应式是_____。
iii.实验⑥的结果说明实验⑤中“无明显现象的原因”是_____。


