��Ŀ����
����Ŀ�����ᡢ�����̼�����������г��������ʡ�
(1)̼����ˮ��Һ�Լ��Ե�ԭ����(�����ӷ���ʽ��ʾ)_____��(2 ��)
(2)25 ��ʱ��Ũ�Ⱦ�Ϊ 0.1 mol��L-1 ������ʹ�����Һ������˵����ȷ��_____��
a.����Һ�� pH ��ͬ
b.����Һ�ĵ���������ͬ
c.����Һ����ˮ������� c(OH-)��ͬ
d.�к͵����ʵ�����NaOH����������Һ�������ͬ
(3)25 ��ʱ�� pH ������ 4 �Ĵ�����Һ���Ȼ����Һ��������Һ��ˮ�������H+Ũ�����Ȼ����Һ��ˮ�������H+Ũ��֮����_____��
(4)������Һ�д��ڵ���ƽ�⣺CH3COOH![]() CH3COO-��H-��������������ȷ����_____��
CH3COO-��H-��������������ȷ����_____��
a. CH3COOH ��Һ������Ũ�ȹ�ϵ���㣺c(H+)��c(OH-)��c(CH3COO-)
b. 0.1 mol��L-1��CH3COOH��Һ��ˮϡ�ͣ���Һ�� c(OH��)��С
c. CH3COOH ��Һ�м������� CH3COONa ���壬ƽ�������ƶ�
d. �����£�pH��2 �� CH3COOH ��Һ�� pH��12 �� NaOH ��Һ�������Ϻ���Һ�� pH��7
e.������ pH=3 �Ĵ�����Һ��ˮϡ�ͣ���Һ��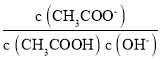 ����
����
���𰸡�CO32-+H2OHCO3-+OH- d 10-6��1 bd
��������
̼������ǿ�������Σ�̼�������ˮ�����Һ�ʼ��ԣ�������һԪǿ����ȫ���롢������һԪ���Ჿ�ֵ��룻������������Ե���ƽ���Ӱ���Լ���Һ�еĵ���غ�ȷ����жϣ���������ˮ�ĵ��룬���������ӵ��δٽ�ˮ�ĵ��롣
(1)̼������ǿ�������Σ�̼�������ˮ�����Һ�ʼ��ԣ�̼�������ˮ�����������Ե�һ��ˮ��Ϊ������һ��ˮ�ⷽ��ʽΪCO32-+H2OHCO3-+OH-��
(2)a��������������ʡ�HCl��ǿ����ʣ���ͬ�¶���ͬŨ���£�������������Ũ�ȴ��ڴ��ᣬ��������pHС�ڴ��ᣬa����
b��������������ʡ�HCl��ǿ����ʣ���ͬ�¶���ͬŨ���£����ᵼ���������ڴ��ᣬb����
c����������ˮ���룬����������Ũ��Խ��������ˮ����̶�Խ����a֪��������������Ũ�ȴ��ڴ��ᣬ����������ˮ�������c(OH-)С�ڴ��ᣬc����
d���к͵����ʵ�����NaOH������������ΪһԪ�ᣬ���������ư����ʵ���֮��1:1��Ӧ�������ĵ�Ũ�ȵ�����ʹ�����Һ�����ͬ��d��ȷ��
��ѡd��
(3)��������ˮ���룬���������ӵ��δٽ�ˮ���룬���Դ�����Һ��ˮ�������c(H+)= ���Ȼ����Һ��ˮ�������c(H+)=10-pH=10-4mol/L�����Դ�����ˮ�������c(H+)���Ȼ����Һ��ˮ�������c(H+)֮��=10-10mol/L��10-4mol/L=10-6��1��
���Ȼ����Һ��ˮ�������c(H+)=10-pH=10-4mol/L�����Դ�����ˮ�������c(H+)���Ȼ����Һ��ˮ�������c(H+)֮��=10-10mol/L��10-4mol/L=10-6��1��
(4)a�����ݵ���غ㣬CH3COOH ��Һ��c(H+)=c(OH-)+c(CH3COO)��a��ȷ��
b.0.1 mol��L-1��CH3COOH��Һ��ˮϡ�ͣ���Һ��c(H+)��С���¶Ȳ���ˮ�����ӻ��������䣬����Һ��c(OH-)����b����
c��CH3COOH��Һ�м�������CH3COONa���壬c(CH3COO)��������ƴ�����룬ƽ�������ƶ���c��ȷ��
d�������£�pH=2��CH3COOH��ҺŨ�ȴ���pH=12��NaOH��Һ���������Ϻ������ʣ�࣬�������̶ȴ��ڴ��������ˮ��̶ȣ����Ի����Һ��pH��7��d����
e����������pH=3�Ĵ�����Һ�м�ˮϡ�ͣ���Һ�� ���¶Ȳ��䣬�������ƽ�ⳣ����ˮ�����ӻ��������䣬������Һ��
���¶Ȳ��䣬�������ƽ�ⳣ����ˮ�����ӻ��������䣬������Һ��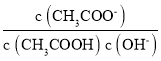 ���䣬e��ȷ��
���䣬e��ȷ��
��ѡbd��

����Ŀ������Ԫ�����ڱ���һ���֣�����Ԫ�ط��š����ӷ��Ż���ػ�ѧʽ�ش��й����⣺
���� ���� | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
2 | �� | �� | �� | |||||
3 | �� | �� | �� | �� | �� | |||
4 | �� | �� |
��1���������γ��������������Ԫ�������ڱ��е�λ����________��
��2��д���ڵ���̬�⻯��Ľṹʽ________��
��3��Ԫ�آܢݢޢ����Ӱ뾶�ɴ�С��˳��________��
��4���١��ޡ�������Ԫ�ص�����������ˮ������������ǿ����________���ܡ��ݡ�������Ԫ�ص�����������ˮ�����м�����ǿ����
��5���ߺ͢������Խ�ǿ����________��һ���û���Ӧ֤ʵ��һ���ۣ�д��ѧ����ʽ��___________________________��
��6���ܢ���Ԫ����Ƚϣ������Խ�ǿ����________��������֤�ý��۵�ʵ����________��
��a�����ڿ����з����Ѿõ�������Ԫ�صĿ�״���ʷֱ������ˮ��
��b������״����С��ͬ��������Ԫ�صĵ�����ɰֽ��ĥ��ֱ��ͬŨ�ȵ����ᷴӦ
��c������״����С��ͬ����Ԫ�صĵ�����ɰֽ��ĥ��ֱ����ˮ���ã��������̪
��d���Ƚ�������Ԫ�ص���̬�⻯����ȶ���
����Ŀ������������Ԫ��A��B��C��D��E��ԭ��������������A��B��C�ĵ����ڳ����¶�����̬��Cԭ�������������ǵ��Ӳ�����3����C��Eλ��ͬ���塣1 mol DAx��������A2C��Ӧ����44.8 L����״����G���塣A��B�ĵ�������ΪG��T�����ܱ������г���һ������G��T��һ�������·�����ӦG+T��W��δ��ƽ������ø����ʵ�Ũ�������ʾ��
���� | T | G | W |
10 minʱ��c/(mol/L) | 0.5 | 0.8 | 0.2 |
20 minʱ��c/(mol/L) | 0.3 | 0.2 | 0.6 |
�ش��������⣺
��1��A��B��C����ɼȺ����Ӽ��ֺ����ۼ��Ļ�����û�����Ļ�ѧʽΪ_________��
��2��B��C��D��E�ļ������У����Ӱ뾶�ɴ�С����Ϊ__________�������ӷ��ű�ʾ����
��3��J��L����A��B��C��E����Ԫ����ɵ����ֳ�����ʽ�Σ�J��L��Ͽɲ����д̼�����ζ�����壬д����������Һ������Ӧ�����ӷ���ʽ__________��J��L����ʹ���Ը��������Һ��ɫ����_______���ѧʽ����
��4��B2A4C2����ȼ�ϵ�طŵ�Ч�ʸߡ��õ�طŵ�ʱ����B2��A2C��������ӦʽΪ________����ع���һ��ʱ��������Һ��pH_____����������������С����������������
����Ŀ��NiCl2�ǻ����ϳ�������Ҫ����Դ����ʵ������ģ�ҵ���Խ���������(��Fe��Al������)Ϊԭ������NiCl2�Ĺ����������£�
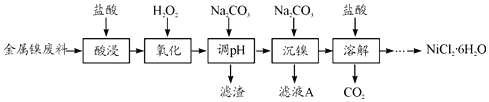
�±��г�����ؽ������������������������pH
�������� | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | Ni(OH)2 |
��ʼ������pH | 2.1 | 6.5 | 3.7 | 7.1 |
������ȫ��pH | 3.3 | 9.7 | 4.7 | 9.2 |
(1)Ϊ�������Ԫ�صĽ����ʣ����������ʱ�ɲ�ȡ�Ĵ�ʩ��__________(дһ������)��
(2)����H2O2ʱ������Ҫ��Ӧ�����ӷ���ʽΪ__________��
(3)����pH��ʱ��������ҺpH�ķ�ΧΪ__________��
(4)�������������У�����ҺA��c(Ni2��)=1.0mol/L����ʹ100mL����Һ�е�Ni2��������ȫ�ۼ���Һ��c(Ni2��)��1.0��10-5�ݣ�������������ƽ��ȡNa2CO3�������������Ϊ_____g��(��֪Ksp(NiCO3)=6.5��10-6��������Һ����ı仯)
(5)����������Һ�õ�NiCl2��6H2O��ʵ�������������Ϊ______�����ˡ�ϴ�ӡ����
����Ŀ��Cl2OΪ���ʹ��ϵĸ�Ч��ȫ���������֮һ��ʵ���ҿ����������Ϳ���(��������������Ϊ1��3�����������뷴Ӧ)�Ļ�����뺬ˮ8%��̼���Ʒ�Ӧ�Ʊ�������ˮ����Cl2O�Ʊ���������Һ������ʵ��װ�ú�Cl2O���������£�

��ɫ | �ػ�ɫ |
״̬ | ���� |
��ζ | ǿ�̼��� |
�۵� | ��116 �� |
�е� | 3.8 �� |
ˮ���� | ��������ˮ����ˮ��Ӧ���ɴ����� |
���ȶ��� | 42 �����Ϸֽ�ΪCl2��O2 |
��1������a������Ϊ________����ʢ�ŵ�ҩƷ��________��
��2��д��װ��A�з�����Ӧ�����ӷ���ʽ��_______________��
��3��װ��C����Ҫ������___________��
��4��װ��D��E�ж��õ�������ݣ���������____________��
��5��д��װ��D��Cl2�����̼���Ʒ�Ӧ����Cl2O�Ļ�ѧ����ʽ��________��
��6��װ��E������ɫԲ����ƿ��ԭ����____________��
��7���Ʊ�Cl2Oװ���д���ȱ�ݣ�������Ľ���ʩ��___________��

