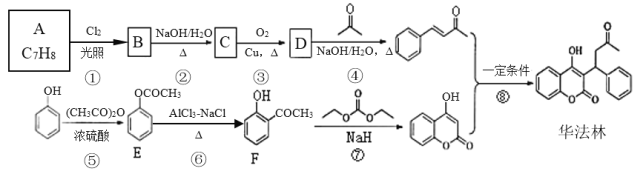
【题目】下列物质的分离提纯中除杂剂及相应的化学方程式分别为:
混合物成分 | 除杂试剂 | 化学方程式 |
(i)铜粉中混有铁粉 | __ | __ |
(ii)铁粉中混有铝粉 | __ | __ |
(iii)Al2O3中混有Al(OH)3 | __ | __ |
(iv)FeCl3溶液中混有FeCl2 | __ | __ |
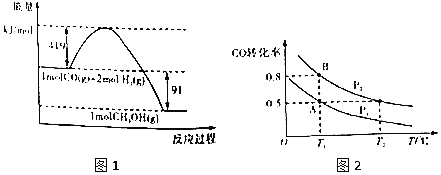
【题目】甲醇是重要的工业原料.煤化工可以利用煤炭制取水煤气从而合成甲醇:CO(g)+2H2(g)![]() CH3OH(g)。常温常压下反应的能量变化如图1所示:
CH3OH(g)。常温常压下反应的能量变化如图1所示:
②
化学键 | H—H | H—O | O=O |
键能kJ/mol | 436 | x | 496 |
③CO(g)+ ![]() O2(g)=CO2(g) △H=-280kJ/mol
O2(g)=CO2(g) △H=-280kJ/mol
H2(g)+![]() O2(g)=H2O(l) △H=-284kJ/mol
O2(g)=H2O(l) △H=-284kJ/mol
H2O(l)=H2O(g) △H=+44kJ/mol
请回答下列问题:
(1)甲醇气体分解为CO和H2两种气体这一反应的活化能为__kJ/mol;
(2)请写出表示气态甲醇燃烧热的热化学方程式__;
(3)H—O的键能x值为__;
(4)如图2:在一容积可变的密闭容器中充入10molCO气体和30molH2气体,当达到平衡状态A时,容器的体积为20L。如反应开始时仍充入10molCO和30molH2,则在平衡状态B时容器的体积V(B)=___L;
(5)在甲、乙、丙三个不同密闭容器中按不同方式投料,一定条件下发生该反应(起始温度和起始体积相同,反应物和生成物反应前后均为气态).相关数据如表所示:
容器 | 甲 | 乙 | 丙 |
相关条件 | 恒温恒容 | 绝热恒容 | 恒温恒压 |
反应物投料 | 1molCO、2molH2 | 1molCH3OH | 1molCH3OH |
平衡时容器体积 | V(甲) | V(乙) | V(丙) |
反应的平衡常数K | K(甲) | K(乙) | K(丙) |
平衡时CH3OH的浓度/molL-1 | C(甲) | C(乙) | C(丙) |
平衡时CH3OH的反应速率/molL-1min-1 | v(甲) | v(乙) | v(丙) |
则下列说法正确的是___。
A.V(甲)>V(丙)
B.K(乙)>K(丙)
C.c(乙)>c(甲)
D.v(甲)=v(丙)
【题目】对下列实验事实的解释正确的是( )
现象 | 解释或结论 | |
A | SO2使酸性高锰酸钾溶液褪色 | SO2表现漂白性 |
B | 向某溶液中加入BaCl2溶液和稀HNO3,若有白色沉淀生成 | 原溶液中含SO42- |
C | 用铂丝蘸取某溶液在酒精灯火焰上灼烧直接观察火焰颜色,未见紫色 | 原溶液中不含K+ |
D | 室温下,向FeCl3溶液中滴加少量KI溶液,再滴加几滴淀粉溶液,溶液变蓝色 | Fe3+的氧化性比I2的强 |
A.AB.BC.CD.D
【题目】下列各组物质中,不能按如图所示![]() “
“![]() ”表示一步完成
”表示一步完成![]() 关系相互转化的是( )
关系相互转化的是( )
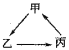
A | B | C | D | |
甲 | Al | Na | SO2 | Cu |
乙 | NaAlO2 | NaOH | SO3 | CuO |
丙 | Al(OH)3 | NaCl | H2SO4 | CuCl2 |
A.AB.BC.CD.D