ЬтФПФкШн
ЁОЬтФПЁПМзДМЪЧживЊЕФЙЄвЕдСЯ.УКЛЏЙЄПЩвдРћгУУКЬПжЦШЁЫЎУКЦјДгЖјКЯГЩМзДМЃКCOЃЈgЃЉ+2H2ЃЈgЃЉ![]() CH3OHЃЈgЃЉЁЃГЃЮТГЃбЙЯТЗДгІЕФФмСПБфЛЏШчЭМ1ЫљЪОЃК
CH3OHЃЈgЃЉЁЃГЃЮТГЃбЙЯТЗДгІЕФФмСПБфЛЏШчЭМ1ЫљЪОЃК
Ђк
ЛЏбЇМќ | HЁЊH | HЁЊO | O=O |
МќФмkJ/mol | 436 | x | 496 |
ЂлCOЃЈgЃЉ+ ![]() O2ЃЈgЃЉ=CO2ЃЈgЃЉ ЁїH=-280kJ/mol
O2ЃЈgЃЉ=CO2ЃЈgЃЉ ЁїH=-280kJ/mol
H2ЃЈgЃЉ+![]() O2ЃЈgЃЉ=H2OЃЈlЃЉ ЁїH=-284kJ/mol
O2ЃЈgЃЉ=H2OЃЈlЃЉ ЁїH=-284kJ/mol
H2OЃЈlЃЉ=H2OЃЈgЃЉ ЁїH=+44kJ/mol
ЧыЛиД№ЯТСаЮЪЬтЃК
ЃЈ1ЃЉМзДМЦјЬхЗжНтЮЊCOКЭH2СНжжЦјЬхетвЛЗДгІЕФЛюЛЏФмЮЊ__kJ/molЃЛ
ЃЈ2ЃЉЧыаДГіБэЪОЦјЬЌМзДМШМЩеШШЕФШШЛЏбЇЗНГЬЪН__ЃЛ
ЃЈ3ЃЉHЁЊOЕФМќФмxжЕЮЊ__ЃЛ
ЃЈ4ЃЉШчЭМ2ЃКдквЛШнЛ§ПЩБфЕФУмБеШнЦїжаГфШы10molCOЦјЬхКЭ30molH2ЦјЬхЃЌЕБДяЕНЦНКтзДЬЌAЪБЃЌШнЦїЕФЬхЛ§ЮЊ20LЁЃШчЗДгІПЊЪМЪБШдГфШы10molCOКЭ30molH2ЃЌдђдкЦНКтзДЬЌBЪБШнЦїЕФЬхЛ§VЃЈBЃЉ=___LЃЛ
ЃЈ5ЃЉдкМзЁЂввЁЂБћШ§ИіВЛЭЌУмБеШнЦїжаАДВЛЭЌЗНЪНЭЖСЯЃЌвЛЖЈЬѕМўЯТЗЂЩњИУЗДгІЃЈЦ№ЪМЮТЖШКЭЦ№ЪМЬхЛ§ЯрЭЌЃЌЗДгІЮяКЭЩњГЩЮяЗДгІЧАКѓОљЮЊЦјЬЌЃЉ.ЯрЙиЪ§ОнШчБэЫљЪОЃК
ШнЦї | Мз | вв | Бћ |
ЯрЙиЬѕМў | КуЮТКуШн | ОјШШКуШн | КуЮТКубЙ |
ЗДгІЮяЭЖСЯ | 1molCOЁЂ2molH2 | 1molCH3OH | 1molCH3OH |
ЦНКтЪБШнЦїЬхЛ§ | VЃЈМзЃЉ | VЃЈввЃЉ | VЃЈБћЃЉ |
ЗДгІЕФЦНКтГЃЪ§K | KЃЈМзЃЉ | KЃЈввЃЉ | KЃЈБћЃЉ |
ЦНКтЪБCH3OHЕФХЈЖШ/molL-1 | CЃЈМзЃЉ | CЃЈввЃЉ | CЃЈБћЃЉ |
ЦНКтЪБCH3OHЕФЗДгІЫйТЪ/molL-1min-1 | vЃЈМзЃЉ | vЃЈввЃЉ | vЃЈБћЃЉ |
дђЯТСаЫЕЗЈе§ШЗЕФЪЧ___ЁЃ
A.VЃЈМзЃЉЃОVЃЈБћЃЉ
B.KЃЈввЃЉЃОKЃЈБћЃЉ
C.cЃЈввЃЉЃОcЃЈМзЃЉ
D.vЃЈМзЃЉ=vЃЈБћЃЉ
ЁОД№АИЁП510 CH3OHЃЈgЃЉ+![]() O2ЃЈgЃЉ=CO2ЃЈgЃЉ+2H2OЃЈlЃЉЁїH=-757kJmol-1 462 7 BC
O2ЃЈgЃЉ=CO2ЃЈgЃЉ+2H2OЃЈlЃЉЁїH=-757kJmol-1 462 7 BC
ЁОНтЮіЁП
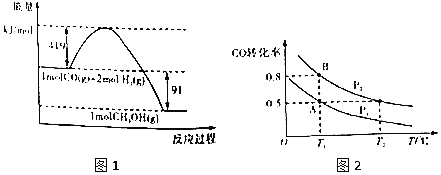
ЛюЛЏФмЮЊЛюЛЏЗжзгОпгаЕФФмСПЃЛШМЩеШШЕФШШЛЏбЇЗНГЬЪНжаЃЌПЩШМЮяЮЊ1molЃЌЗДгІЩњГЩЮШЖЈЕФбѕЛЏЮяЃЌгЩЭМ1ПЩЕУШШЛЏбЇЗНГЬЪНЃКЂйCOЃЈgЃЉ+2H2ЃЈlЃЉ=CH3OHЃЈgЃЉЁїH=-91kJ/molЃЛЗДгІШШ=ЗДгІЮязмМќФм-ЩњГЩЮязмМќФмЃЌНјЖјМЦЫуxЕФжЕЃЛКЯГЩМзДМЕФЗДгІЮЊЗХШШЗДгІЃЌМзЮЊКуЮТКуШнЃЌввЮЊОјШШКуШнЃЌввЮТЖШНЕЕЭЃЌЦНКтГЃЪ§діДѓЃЌБћКуЮТКубЙЃЌЬхЛ§гІдіДѓЁЃ
(1)гЩЭМЯёПЩжЊМзДМЕФЛюЛЏФмЮЊЃЈ419+91ЃЉkJ/mol=510kJ/molЁЃ
(2)ШМЩеШШЕФШШЛЏбЇЗНГЬЪНжаЃЌПЩШМЮяЮЊ1molЃЌЗДгІЩњГЩЮШЖЈЕФбѕЛЏЮяЁЃгЩЭМ1ПЩЕУШШЛЏбЇЗНГЬЪНЃКЂйCOЃЈgЃЉ+2H2ЃЈlЃЉ=CH3OHЃЈgЃЉЁїH=-91kJ/molЃЌгжвбжЊЃКЂкCOЃЈgЃЉ+![]() O2ЃЈgЃЉЈTCO2ЃЈgЃЉЁїH=-280kJ/mol ЂлH2ЃЈgЃЉ+
O2ЃЈgЃЉЈTCO2ЃЈgЃЉЁїH=-280kJ/mol ЂлH2ЃЈgЃЉ+![]() O2ЃЈgЃЉЈTH2OЃЈlЃЉЁїH=-284 kJ/molЃЌИљОнИЧЫЙЖЈТЩЃЌЂлЁС2+Ђк-ЂйПЩЕУCH3OHЃЈgЃЉ+
O2ЃЈgЃЉЈTH2OЃЈlЃЉЁїH=-284 kJ/molЃЌИљОнИЧЫЙЖЈТЩЃЌЂлЁС2+Ђк-ЂйПЩЕУCH3OHЃЈgЃЉ+![]() O2ЃЈgЃЉ=CO2ЃЈgЃЉ+2H2OЃЈlЃЉЁїH=-757kJmol-1ЁЃ
O2ЃЈgЃЉ=CO2ЃЈgЃЉ+2H2OЃЈlЃЉЁїH=-757kJmol-1ЁЃ
(3)вбжЊЃКH2ЃЈgЃЉ+![]() O2ЃЈgЃЉЈTH2OЃЈlЃЉЁїH=-284 kJ/molЃЌH2OЃЈlЃЉЈTH2OЃЈgЃЉЁїH=+44kJ/mol
O2ЃЈgЃЉЈTH2OЃЈlЃЉЁїH=-284 kJ/molЃЌH2OЃЈlЃЉЈTH2OЃЈgЃЉЁїH=+44kJ/mol
ЖўепЯрМгПЩЕУЃКH2ЃЈgЃЉ+![]() O2ЃЈgЃЉЈTH2OЃЈgЃЉЁїH=-240 kJ/molЃЛЗДгІШШ=ЗДгІЮязмМќФм-ЩњГЩЮязмМќФмЃЌдђ436kJ/mol+
O2ЃЈgЃЉЈTH2OЃЈgЃЉЁїH=-240 kJ/molЃЛЗДгІШШ=ЗДгІЮязмМќФм-ЩњГЩЮязмМќФмЃЌдђ436kJ/mol+![]() ЁС496kJ/mol-2ЁСx kJ/mol=-240kJ/molЃЌНтЕУx=462ЁЃ
ЁС496kJ/mol-2ЁСx kJ/mol=-240kJ/molЃЌНтЕУx=462ЁЃ
(4)AЁЂBСНШнЦїЮТЖШЯрЭЌЃЌМДЛЏбЇЦНКтГЃЪ§ЯрЕШЃЌгЩЭМПЩжЊAЕуЪБCOЕФзЊЛЏТЪЮЊ50%ЃЌдђЦНКтЪБCOЕФЮяжЪЕФСПЮЊ5molЃЌH2ЕФЮяжЪЕФСПЮЊ20molЃЌМзДМЕФЮяжЪЕФСПЮЊ5molЃЌдђ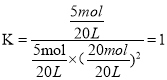 ЃЛдкBЕуЪБCOЕФзЊЛЏТЪЮЊ0.8ЃЌЦНКтЪБCOЕФЮяжЪЕФСПЮЊЃЈ10mol-10mol
ЃЛдкBЕуЪБCOЕФзЊЛЏТЪЮЊ0.8ЃЌЦНКтЪБCOЕФЮяжЪЕФСПЮЊЃЈ10mol-10mol![]() 0.8ЃЉ=2molЃЌH2ЕФЮяжЪЕФСПЮЊЃЈ30mol-2
0.8ЃЉ=2molЃЌH2ЕФЮяжЪЕФСПЮЊЃЈ30mol-2![]() 8molЃЉ=14molЃЌМзДМЕФЮяжЪЕФСПЮЊ8molЃЌЩшЬхЛ§ЮЊVLЃЌдђгаK=
8molЃЉ=14molЃЌМзДМЕФЮяжЪЕФСПЮЊ8molЃЌЩшЬхЛ§ЮЊVLЃЌдђгаK=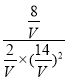 =1ЃЌНтЕУV=7LЁЃ
=1ЃЌНтЕУV=7LЁЃ
(5)AЃЎБћЮЊМзДМЕФЗжНтЃЌЪЧЦјЬхЬхЛ§діДѓЕФЗДгІЃЌЫљвдБћКуЮТКубЙЃЌЬхЛ§БфДѓЃЌМзКуЮТКуШнЃЌЬхЛ§ВЛБфЃЌЫљвдЃЌVМзЃМVБћЃЌAДэЮѓЃЛ
BЃЎКЯГЩМзДМЪЧЗХШШЗДгІЃЌЦфФцЗДгІМзДМЗжНтОЭЪЧЮќШШЕФЃЌввОјШШШнЦїЃЌБћКуЮТЃЌЫљвдввЗДгІКѓБШБћЮТЖШЕЭЃЌЯђЮќШШЗНЯђНјааЕФГЬЖШаЁЃЌЦНКтЪБввжаМзДМХЈЖШБШБћИпЃЌCOКЭЧтЦјХЈЖШБШБћЕЭЃЌKввЃОKБћЃЌBе§ШЗЃЛ
CЃЎЬѕМўЯрЭЌЪБЃЌМзгыввЪЧЕШаЇЦНКтЃЎМзгыввШнЦїЬхЛ§ЯрЭЌЃЌввЗжНтМзДМЮќШШЕМжТввБШМзЮТЖШЕЭЃЌЦНКтЯђКЯГЩМзДМЗНЯђвЦЖЏЃЌЦНКтЪБМзДМХЈЖШввДѓгкМзЃЌМДcввЃОcМзЃЌCе§ШЗЃЛ
DЃЎМзгыБћЦ№ЪМЮТЖШКЭЦ№ЪМЬхЛ§ЯрЭЌЃЌКуЮТЬѕМўЯТЗДгІЃЌБћдкКубЙЬѕМўЯТЗжНтМзДМЩњГЩЧтЦјКЭCOЃЌЦНКтЪБЬхЛ§БШЗДгІЧАДѓЃЌМДЦНКтЪББћЬхЛ§ДѓгкМзЃЌдђбЙЧПМзДѓгкБћЃЌЫљвдІдМзЃОІдБћЃЌDДэЮѓЃЛ
Д№АИбЁBCЁЃ

 ПкЫуЬтПЈМггІгУЬтМЏбЕЯЕСаД№АИ
ПкЫуЬтПЈМггІгУЬтМЏбЕЯЕСаД№АИ злКЯздВтЯЕСаД№АИ
злКЯздВтЯЕСаД№АИЁОЬтФПЁПЯТСаЮяжЪЕФЗжРыЬсДПжаГ§дгМСМАЯргІЕФЛЏбЇЗНГЬЪНЗжБ№ЮЊЃК
ЛьКЯЮяГЩЗж | Г§дгЪдМС | ЛЏбЇЗНГЬЪН |
ЃЈiЃЉЭЗлжаЛьгаЬњЗл | __ | __ |
ЃЈiiЃЉЬњЗлжаЛьгаТСЗл | __ | __ |
ЃЈiiiЃЉAl2O3жаЛьгаAlЃЈOHЃЉ3 | __ | __ |
ЃЈivЃЉFeCl3ШмвКжаЛьгаFeCl2 | __ | __ |