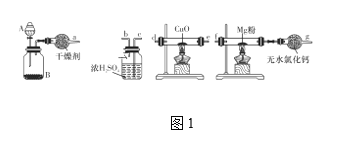
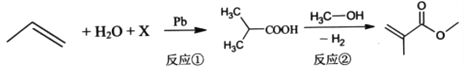
题目内容
【题目】A、B是中学化学常见的化合物,它们各由两种元素组成;乙为元素R组成的单质,它们之间存在如图所示关系.根据要求回答问题:
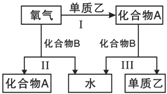
![]() 如图三个反应中,属于氧化还原反应的有______个.
如图三个反应中,属于氧化还原反应的有______个.
![]() 若元素R与氧同主族,下列事实能说明R与氧的非金属性相对强弱的有______.
若元素R与氧同主族,下列事实能说明R与氧的非金属性相对强弱的有______.
A.还原性:![]() B.酸性:
B.酸性:![]()
C.稳定性:![]() C.沸点:
C.沸点:![]()
![]() 若化合物B常温下为气体,其水溶液呈碱性
若化合物B常温下为气体,其水溶液呈碱性![]() 答题必须用具体物质表示
答题必须用具体物质表示![]() .
.
![]() 化合物B的电子式为______;其水溶液呈碱性的原因是______
化合物B的电子式为______;其水溶液呈碱性的原因是______![]() 用离子方程式表示
用离子方程式表示![]() .
.
![]() 化合物B可与
化合物B可与![]() 组成燃料电池
组成燃料电池![]() 氢氧化钾溶液为电解质溶液
氢氧化钾溶液为电解质溶液![]() ,其反应产物与反应Ⅲ相同.写出该电池负极的电极反应式______.
,其反应产物与反应Ⅲ相同.写出该电池负极的电极反应式______.
![]() 当1mol的化合物B分别参与反应Ⅱ、Ⅲ时,热效应为
当1mol的化合物B分别参与反应Ⅱ、Ⅲ时,热效应为![]() 和
和![]() ,则反应Ⅰ的热化学方程式为______
,则反应Ⅰ的热化学方程式为______![]() 注:反应条件相同、所有物质均为气体
注:反应条件相同、所有物质均为气体![]() .
.
【答案】3 A、C ![]()
![]()
![]()
![]()
![]()
![]()
【解析】
![]() 、B是中学化学常见的化合物,它们各由两种元素组成,乙为元素R组成的单质,反应Ⅰ、Ⅱ为有氧气参加的反应,应为氧化还原反应,反应Ⅲ由化合物A、B反应生成单质,也应为氧化还原反应;
、B是中学化学常见的化合物,它们各由两种元素组成,乙为元素R组成的单质,反应Ⅰ、Ⅱ为有氧气参加的反应,应为氧化还原反应,反应Ⅲ由化合物A、B反应生成单质,也应为氧化还原反应;
![]() 元素R与氧同主族,则R为硫元素,硫的非金属性弱于氧,根据元素周期律判断;
元素R与氧同主族,则R为硫元素,硫的非金属性弱于氧,根据元素周期律判断;
![]() 若化合物B常温下为气体,其水溶液呈碱性,则B为
若化合物B常温下为气体,其水溶液呈碱性,则B为![]() ,根据转化关系可知,A为NO,乙为
,根据转化关系可知,A为NO,乙为![]() ,据此答题。
,据此答题。
![]() 、B是中学化学常见的化合物,它们各由两种元素组成,乙为元素R组成的单质,反应Ⅰ、Ⅱ为有氧气参加的反应,应为氧化还原反应,反应Ⅲ由化合物A、B反应生成单质,也应为氧化还原反应,所以属于氧化还原反应的有Ⅰ、Ⅱ、Ⅲ,共3个;
、B是中学化学常见的化合物,它们各由两种元素组成,乙为元素R组成的单质,反应Ⅰ、Ⅱ为有氧气参加的反应,应为氧化还原反应,反应Ⅲ由化合物A、B反应生成单质,也应为氧化还原反应,所以属于氧化还原反应的有Ⅰ、Ⅱ、Ⅲ,共3个;
![]() 元素R与氧同主族,则R为硫元素,硫的非金属性弱于氧,根据元素周期律可知,能说明S与氧的非金属性相对强弱的有,还原性:
元素R与氧同主族,则R为硫元素,硫的非金属性弱于氧,根据元素周期律可知,能说明S与氧的非金属性相对强弱的有,还原性:![]() 、稳定性:
、稳定性:![]() ,故答案为:A、C;
,故答案为:A、C;
![]() 若化合物B常温下为气体,其水溶液呈碱性,则B为
若化合物B常温下为气体,其水溶液呈碱性,则B为![]() ,根据转化关系可知,A为NO,乙为
,根据转化关系可知,A为NO,乙为![]() ;
;
![]() 化合物B的电子式为
化合物B的电子式为![]() ;其水溶液呈碱性的原因是一水合氨电离产生氢氧根离子,离子方程式为
;其水溶液呈碱性的原因是一水合氨电离产生氢氧根离子,离子方程式为![]()
![]()
![]() ;
;
![]() 化合物
化合物![]() 与
与![]() 组成燃料电池
组成燃料电池![]() 氢氧化钾溶液为电解质溶液
氢氧化钾溶液为电解质溶液![]() ,电池负极为氨气发生氧化反应生成氮气和水,电极反应式为
,电池负极为氨气发生氧化反应生成氮气和水,电极反应式为![]() ;
;
![]() 当1mol的化合物B分别参与反应Ⅱ、Ⅲ时,热效应为
当1mol的化合物B分别参与反应Ⅱ、Ⅲ时,热效应为![]() 和
和![]() ,根据盖斯定律,将反应反应
,根据盖斯定律,将反应反应![]() Ⅰ
Ⅰ![]() Ⅱ
Ⅱ![]() 可得反应Ⅰ的热化学方程式为
可得反应Ⅰ的热化学方程式为![]() 。
。

 优生乐园系列答案
优生乐园系列答案 新编小学单元自测题系列答案
新编小学单元自测题系列答案【题目】S2Cl2和SCl2均为重要的化工原料,都满足8电子稳定结构。
已知:①S2(1)+Cl2(g)![]() S2Cl2(g) △H1=xkJ/mol
S2Cl2(g) △H1=xkJ/mol
②S2Cl2(g)+Cl2(g)![]() 2SCl2(g) △H2=ykJ/mol
2SCl2(g) △H2=ykJ/mol
③相关化学键的键能如下表所示:
化学键 | S-S | S-Cl | Cl-Cl |
键能/kJ/mol | a | b | c |
下列说法错误的是
A. SCl2的结构式为C1-S-Cl B. S2Cl2的电子式为: ![]()
C. y=2b-a-c D. 在S2(1)+2Cl2(g)![]() 2SCl2(g)的反应中,△H=(x+y)kJ/mol
2SCl2(g)的反应中,△H=(x+y)kJ/mol
【题目】温度为T1时,在三个容积均为1 L的恒容密闭容器中仅发生反应 2NO2(g)2NO(g)+O2(g) ΔH>0。实验测得:υ正=υ(NO2)消耗=k正c2(NO2),υ逆=υ(NO)消耗=2υ(O2)消耗=k逆c2(NO)·c(O2),k正、k逆为速率常数,受温度影响。下列说法正确的是( )
容器编号 | 物质的起始浓度(mol·L-1) | 物质的平衡浓度(mol·L-1) | ||
c(NO2) | c(NO) | c(O2) | c(O2) | |
Ⅰ | 0.6 | 0 | 0 | 0.2 |
Ⅱ | 0.3 | 0.5 | 0.2 | |
Ⅲ | 0 | 0.5 | 0.35 | |
A.反应达平衡时,容器Ⅰ与容器Ⅱ中的总压强之比为1∶1
B.反应达平衡时,容器Ⅱ中![]() 比容器Ⅰ中的大
比容器Ⅰ中的大
C.反应达平衡时,容器Ⅲ中NO的体积分数大于50%
D.当温度改变为T2时,若k正=k逆,则T2>T1