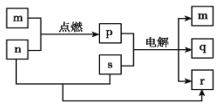
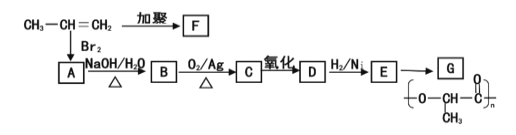
题目内容
【题目】下列离子方程式书写不正确的是![]()
A.![]() 溶液与烧碱溶液反应,当
溶液与烧碱溶液反应,当![]() :
:![]() :2时,
:2时,![]()
B.当向饱和![]() 溶液中通入过量
溶液中通入过量![]() 时,
时,![]()
C.![]() 与NaHS溶液反应,当
与NaHS溶液反应,当![]() :
:![]() :2时,
:2时,![]() 十
十![]()
D.Fe与稀硝酸反应,当![]() :
:![]() :2时,
:2时,![]()
【答案】B
【解析】
A.![]() 溶液与烧碱溶液反应,少量氢氧化钠溶液反应时,发生反应:
溶液与烧碱溶液反应,少量氢氧化钠溶液反应时,发生反应:![]() ,氢氧化钠过量,发生
,氢氧化钠过量,发生![]() ;
;
B.当向饱和![]() 溶液中通入过量
溶液中通入过量![]() 时会生成碳酸氢钠沉淀;
时会生成碳酸氢钠沉淀;
C.![]() 溶液与 NaHS溶液当
溶液与 NaHS溶液当![]() :
:![]() :2时,反应生成硫化铜和硫化氢;
:2时,反应生成硫化铜和硫化氢;
D.过量的铁与稀硝酸反应生成硝酸亚铁,若铁不足时生成硝酸铁.
A.![]() 溶液与烧碱溶液反应,当
溶液与烧碱溶液反应,当![]() :
:![]() :2时,假设
:2时,假设![]() 为2mol,生成
为2mol,生成![]() ,需氢氧化钠6mol,剩余1mol氢氧化钠,溶解
,需氢氧化钠6mol,剩余1mol氢氧化钠,溶解![]() ,离子方程式为
,离子方程式为![]() ,故A正确;
,故A正确;
B.当向饱和![]() 溶液中通入过量
溶液中通入过量![]() 时会生成碳酸氢钠沉淀,其反应的离子方程式为:
时会生成碳酸氢钠沉淀,其反应的离子方程式为:![]() ,故B错误;
,故B错误;
C.NaHS溶液为二元弱酸氢硫酸的酸式盐,当![]() :
:![]() :2时,
:2时,![]() 溶液与 NaHS溶液反应,生成硫化铜和硫化氢,离子方程式为:
溶液与 NaHS溶液反应,生成硫化铜和硫化氢,离子方程式为:![]() ,故C正确;
,故C正确;
D.过量的铁与稀硝酸反应生成硝酸亚铁:![]() ,若铁不足时生成硝酸铁:
,若铁不足时生成硝酸铁:![]() ,Fe与稀硝酸反应,当
,Fe与稀硝酸反应,当![]() :
:![]() :2时,铁过量,发生反应:
:2时,铁过量,发生反应:![]() ,故D正确;
,故D正确;
故选:B。

【题目】电镀行业产生的酸性含铬废水对环境有污染,其中所含的Cr(Ⅵ)是主要污染物,可采用多种处理方法将其除去。查阅资料可知:
①在酸性环境下,Cr(Ⅵ)通常以Cr2O72-的形式存在;
②Cr2O72-的氧化能力强于CrO42-;
③常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下表所示:
阳离子 | Fe3+ | Fe2+ | Cr3+ |
开始沉淀的pH | 1.9 | 7.0 | 4.3 |
沉淀完全的pH | 3.2 | 9.0 | 5.6 |
Ⅰ.腐蚀电池法
(1)向酸性含铬废水中投放废铁屑和焦炭,利用原电池原理还原Cr(Ⅵ)。下列关于焦炭的说法正确的是_______(填字母代号)。
a.作原电池的正极 b.在反应中作还原剂 c.表面可能有气泡产生
Ⅱ.电解还原法
向酸性含铬废水中加入适量NaCl固体,以Fe为电极电解,经过一段时间,有Cr(OH)3和Fe(OH)3沉淀生成排出,从而使废水中铬含量低于排放标准。电解装置如图1所示。

(2)A极连接电源的______________极,A极上发生的电极反应式为_______________
(3)电解开始时,B极上除了发生产生H2的反应外,还有少量Cr2O72-在B极上直接放电,该反应的电极反应式为_________________
(4)电解过程中,溶液的pH不同时,通电时间(t)与溶液中铬元素去除率的关系如图2所示。

①由图可知,电解还原法应采取的最佳pH范围为____(填字母代号)。
a.2~4 b.4~6 c.6~10
②解释曲线Ⅰ和曲线Ⅳ去除率低的原因:________________