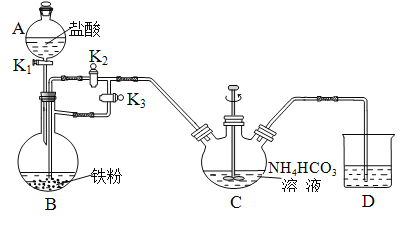
【题目】(1)水的电离平衡曲线如图所示,若A点表示25 ℃时水的电离达平衡时的离子浓度,B点表示100 ℃时水的电离达平衡时的离子浓度。则100 ℃时pH=12的NaOH溶液100mL,要使它的pH为11。(体积变化忽略不计)

①如果加入蒸馏水,应加_________mL;
②如果加入pH=10的NaOH溶液,应加_________mL;
(2)25 ℃时,向水的电离平衡体系中加入少量NH4Cl固体,对水的电离平衡的影响是________(填“促进”、 “抑制”或“不影响”)。
已知如表数据。
化学式 | 电离平衡常数(25 ℃) |
HCN | K=4.9×10-10 |
CH3COOH | K=1.8×10-5 |
H2CO3 | K1=4.3×10-7 K2=5.6×10-11 |
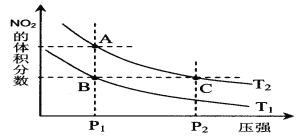
(3)25 ℃时,有等浓度的NaCN溶液、Na2CO3溶液、CH3COONa溶液,三种溶液的pH由大到小的顺序为_________。(填化学式)
(4)25 ℃时,等浓度的CH3COOH溶液和NaOH溶液等体积混合,所得溶液显碱性,则c(Na+)________c(CH3COO-)(填“>”、“<”或“=”)。
(5)向NaCN溶液中通入少量CO2,反应的化学方程式为____________。
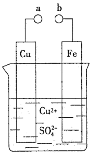
【题目】实验室中用氯气与粗铜![]() 杂质只有Fe)反应,制备CuCl2·2H2O晶体的流程如下
杂质只有Fe)反应,制备CuCl2·2H2O晶体的流程如下

已知:氯化铜从水溶液中结晶时,所得晶体CuCl2·2H2O与温度关系如下
温度 | 小于15℃ | 15—25.7℃ | 26—42℃ | 42—100℃ | 100℃以上 |
晶体 | CuCl2·4H2O | CuCl2·3H2O | CuCl2·2H2O | CuCl2·H2O | CuCl2 |
下列说法不正确的是
A.制备氯气的反应:MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
B.由溶液乙制备纯净CuCl2·2H2O晶体的系列操作步骤为:加少量盐酸、蒸发浓缩、冷却到室温结晶、过滤、洗涤、干燥。
C.固体乙是氢氧化铁
D.此流程中溶解固体甲的酸只能是盐酸