题目内容
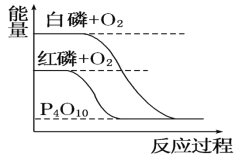
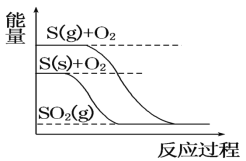
【题目】以下对化学反应描述的观点中正确的有几项:①放热反应在常温下均能自发进行;②电解过程中,化学能转化为电能而“储存”起来;③原电池工作时所发生的反应一定有氧化还原反应;④加热时,化学反应只向吸热反应方向进行;⑤盐类均能发生水解反应;⑥相同温度下,同一反应的化学平衡常数的大小与化学反应方程式的书写有关( )
A.1项B.2项C.3项D.4项
【答案】B
【解析】
①放热反应是指:反应物的总能量大于生成物的总能量,与常温下能自发进行无关,如:碳在空气中燃烧,须加热达到碳的着火点才可进行,故①错误;
②电解过程中,需要消耗电能,是将电能转化为化学能,故②错误;
③原电池工作时,是将化学能转化电能,有电流产生,则有电子的定向移动,所以所发生的反应一定有氧化还原反应,故③正确;
④加热时,提供能量,无论是吸热反应,还是放热反应,反应速率都要加快,故④错误;
⑤盐类水解的规律为:无弱不水解,有弱才水解,越弱越水解,谁强显谁性,弱是指弱酸或弱碱的离子,故⑤错误;
⑥化学平衡常数的表达式为:化学平衡常数![]() ,与化学反应方程式的书写有关,故⑥正确;
,与化学反应方程式的书写有关,故⑥正确;
故选B。

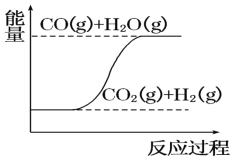
【题目】实现碳及其化合物的相互转化,对开发新能源和降低碳排放意义重大。
(1)已知:CH4(g)+H2O(g)![]() CO(g)+3H2(g) △H=x
CO(g)+3H2(g) △H=x
已知:标准状态下,由最稳定的单质生成1mol化合物的焓变,称为该化合物的标准摩尔生成焓,几种物质的标准摩尔生成焓如下。则x=__kJ·mol-1。(标准摩尔生成焓:CH4(g)-75kJ/mol;H2O(g)-240kJ/mol;CO(g)-110kJ/mol;H2(g)-0kJ/mol)
(2)为了探究温度、压强对反应(1)的影响,在恒温恒容下,向下列三个容器中均充入4molCH4和4molH2O。
容器 | 温度/℃ | 体积/L | CH4平衡浓度/mol·L-1 | 平衡时间/min |
甲 | 400 | 1 | 1.5 | 5.0 |
乙 | 500 | 1 | x | t1 |
丙 | 400 | 2 | y | t2 |
①平衡前,容器甲中反应的平均速率![]() (H2)=__mol/(L·min);在一定条件下,能判断容器丙中的反应一定处于化学平衡状态的是__(填序号);
(H2)=__mol/(L·min);在一定条件下,能判断容器丙中的反应一定处于化学平衡状态的是__(填序号);
A.3v(CH4)正=v(H2)逆 B.CH4和H2O的转化率相等
C.容器内压强保持不变 D.混合气体的密度保持不变
②平衡后,乙容器中CH4的转换率较丙低,其原因是__,其中t1__t2(填“>”、 “<”或“=”)。
(3)pC是指极稀溶液中溶质物质的量浓度的负对数。已知常温下,H2CO3溶液中加入强酸或强碱后达到平衡时溶液中三种成分的pC-pH图,据图
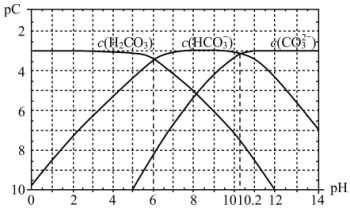
常温下,碳酸的一级电离常数Ka1的数量级为__;其中碳酸的Ka1>>Ka2,其原因是__。
(4)我国科学家根据反应CO2![]() C+O2↑,结合电解池原理设计出了二氧化碳捕获与转化装置。该装置首先利用电解池中熔融电解质ZrO捕获CO2,发生的相关反应为:①CO2+O2-=CO32-,②2CO2+O2-=C2O52-,然后CO32-在阴极转化为碳单质和__;C2O52-在阳极发生电极反应,其方程式为__。
C+O2↑,结合电解池原理设计出了二氧化碳捕获与转化装置。该装置首先利用电解池中熔融电解质ZrO捕获CO2,发生的相关反应为:①CO2+O2-=CO32-,②2CO2+O2-=C2O52-,然后CO32-在阴极转化为碳单质和__;C2O52-在阳极发生电极反应,其方程式为__。
【题目】(1)水的电离平衡曲线如图所示,若A点表示25 ℃时水的电离达平衡时的离子浓度,B点表示100 ℃时水的电离达平衡时的离子浓度。则100 ℃时pH=12的NaOH溶液100mL,要使它的pH为11。(体积变化忽略不计)
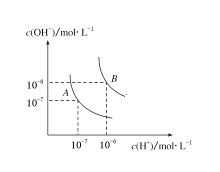
①如果加入蒸馏水,应加_________mL;
②如果加入pH=10的NaOH溶液,应加_________mL;
(2)25 ℃时,向水的电离平衡体系中加入少量NH4Cl固体,对水的电离平衡的影响是________(填“促进”、 “抑制”或“不影响”)。
已知如表数据。
化学式 | 电离平衡常数(25 ℃) |
HCN | K=4.9×10-10 |
CH3COOH | K=1.8×10-5 |
H2CO3 | K1=4.3×10-7 K2=5.6×10-11 |
(3)25 ℃时,有等浓度的NaCN溶液、Na2CO3溶液、CH3COONa溶液,三种溶液的pH由大到小的顺序为_________。(填化学式)
(4)25 ℃时,等浓度的CH3COOH溶液和NaOH溶液等体积混合,所得溶液显碱性,则c(Na+)________c(CH3COO-)(填“>”、“<”或“=”)。
(5)向NaCN溶液中通入少量CO2,反应的化学方程式为____________。