题目内容
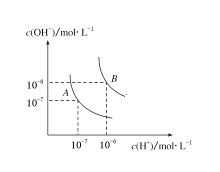
【题目】(1)水的电离平衡曲线如图所示,若A点表示25 ℃时水的电离达平衡时的离子浓度,B点表示100 ℃时水的电离达平衡时的离子浓度。则100 ℃时pH=12的NaOH溶液100mL,要使它的pH为11。(体积变化忽略不计)
①如果加入蒸馏水,应加_________mL;
②如果加入pH=10的NaOH溶液,应加_________mL;
(2)25 ℃时,向水的电离平衡体系中加入少量NH4Cl固体,对水的电离平衡的影响是________(填“促进”、 “抑制”或“不影响”)。
已知如表数据。
化学式 | 电离平衡常数(25 ℃) |
HCN | K=4.9×10-10 |
CH3COOH | K=1.8×10-5 |
H2CO3 | K1=4.3×10-7 K2=5.6×10-11 |
(3)25 ℃时,有等浓度的NaCN溶液、Na2CO3溶液、CH3COONa溶液,三种溶液的pH由大到小的顺序为_________。(填化学式)
(4)25 ℃时,等浓度的CH3COOH溶液和NaOH溶液等体积混合,所得溶液显碱性,则c(Na+)________c(CH3COO-)(填“>”、“<”或“=”)。
(5)向NaCN溶液中通入少量CO2,反应的化学方程式为____________。
【答案】900 1000 促进 ![]() >
> ![]()
【解析】
(1)①先根据溶液的pH计算氢氧根离子浓度,再根据c1V1=c2(V1+V2)计算加入的水体积;
②先根据溶液的pH计算氢氧根离子浓度,再根据c1V1+c2V2=c3(V1+V2)计算加入的氢氧化钠溶液体积;
(2)盐类水解促进水的电离;
(3)弱酸的电离平衡常数越大,酸性越强;
(4)等浓度的CH3COOH溶液和NaOH溶液等体积混合,酸过量;
(5)酸性强弱顺序是CH3COOH>H2CO3>HCN>HCO3-,则根据较强酸制备较弱酸的原理判断。
(1)①pH=12 的NaOH溶液中氢氧根离子浓度是0.01mol/L,pH=11的氢氧化钠溶液中氢氧根离子浓度是0.001mol/L,设加入水的体积是V2,c1V1=c2(V1+V2)=0.01mol/L×0.1L=0.001mol/L×(0.1+V2)L,V2=![]() -0.1L=0.9L=900mL;
-0.1L=0.9L=900mL;
②pH=10的氢氧化钠溶液中c(OH-)=0.0001mol/L,
设pH=10的氢氧化钠的体积为yL,则0.01mol/L×0.1L+0.0001mol/L×yL=0.001mol/L×(0.1+y)L,y=1L=1000mL;
(2)氯化铵溶于水NH4+水解,促进水的电离,因此25 ℃时,向水的电离平衡体系中加入少量NH4Cl固体,对水的电离平衡的影响是促进;
(3)弱酸的电离平衡常数越大,酸性越强。则根据电离平衡常数可知,酸性强弱顺序是CH3COOH>H2CO3>HCN>HCO3-。又因为酸性越弱,相应的钠盐越容易水解,溶液的碱性越强,因此25℃时,有等浓度的①NaCN溶液、②Na2CO3溶液、③CH3COONa溶液,三种溶液的pH由大到小的顺序为②Na2CO3溶液>①NaCN溶液>③CH3COONa溶液;
(4)等浓度的CH3COOH溶液和NaOH溶液等体积混合,所得溶液显碱性,则c(H+)<c(OH-)由电荷守恒:c(Na+)+c(H+)=c(CH3COO-)+c(OH-),得c(Na+)>c(CH3COO-);
(5)酸性强弱顺序是CH3COOH>H2CO3>HCN>HCO3-,则根据较强酸制备较弱酸的原理可知,向NaCN溶液中通入少量CO2,所发生反应的化学方程式为NaCN+H2O+CO2=HCN+NaHCO3。