题目内容
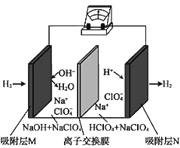
【题目】某小组为研究电化学原理,设计如图装置。下列叙述正确的是( )

A.a和b用导线连接时,铁电极上发生还原反应
B.a和b用导线连接时,电子经硫酸铜溶液从铁电极流向铜电极
C.无论a和b是否连接,铜电极质量都增加
D.无论a和b是否连接,铁片均会溶解,溶液均从蓝色逐渐变成浅绿色
【答案】D
【解析】
A.a和b用导线连接时,形成了原电池,Fe作负极,失去电子,发生氧化反应,A错误;
B.a和b用导线连接时,形成了原电池,Fe片作负极,失去电子,发生氧化反应,电子经导线流向Cu片,溶液中Cu2+在Cu片上得到电子发生还原反应,B错误;
C.a和b不连接时,铁片和硫酸铜溶液直接发生化学反应,铁将金属铜从其盐中置换出来,产生的Cu在铁片上附着,使铁片质量增加,而铜电极质量不变;当a和b用导线连接时,形成了原电池,溶液中Cu2+在Cu片上得到电子发生还原反应,产生Cu单质在Cu片上附着,使铜电极质量增加,可见Cu电极质量不一定都增加,C错误;
D.a和b不连接时,铁片和硫酸铜溶液之间发生化学反应,铁能将金属铜从其盐中置换出来,Fe变为Fe2+进入溶液;当a和b用导线连接时,形成了原电池,加快了铁将金属铜从其盐中置换出来的速度,Fe为负极,失去电子被氧化变为Fe2+进入溶液。可见无论a和b是否连接,铁片均会溶解生成+2价的Fe2+,导致溶液均从蓝色逐渐变成浅绿色,D正确;
故合理选项是D。

 导学与测试系列答案
导学与测试系列答案 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案【题目】亚硝酰氯(NOCl,熔点:-64.5 ℃,沸点:-5.5 ℃)是一种黄色气体,遇水易反应,生成一种氯化物和两种氧化物。可用于合成清洁剂、触媒剂及中间体等。实验室可由氯气与一氧化氮在常温常压下合成。
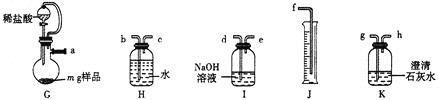
(1)甲组的同学拟制备原料气NO和Cl2,制备装置如下图所示:
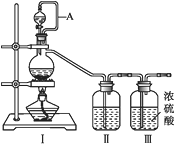
为制备纯净干燥的气体,下表中缺少的药品是:
装置Ⅰ | 装置Ⅱ | ||
烧瓶中 | 分液漏斗中 | ||
制备纯净Cl2 | MnO2 | ① | ② |
制备纯净NO | Cu | ③ | ④ |
②___________,③___________。
(2)乙组同学利用甲组制得的NO和Cl2制备NOCl,装置如图所示:

①装置连接顺序为a→___________________(按气流自左向右方向,用小写字母表示)。
②装置Ⅶ的作用为________________,若无该装置,Ⅸ中NOCl可能发生反应的化学方程式为_______________________________。
③乙组同学认为氢氧化钠溶液只能吸收氯气和NOCl,不能吸收NO,所以装置Ⅷ不能有效除去有毒气体。为解决这一问题,可将尾气与某种气体同时通入氢氧化钠溶液中,这种气体的化学式是__________。
(3)丙组同学查阅资料,查得王水是浓硝酸与浓盐酸的混酸,一定条件下混酸可生成亚硝酰氯和氯气,该反应的化学方程式为___________________。
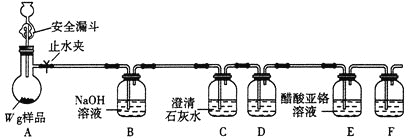
(4)丁组同学用以下方法测定亚硝酰氯(NOCl)纯度
取Ⅸ中所得液体mg溶于水,配制成250mL溶液;取出25.00mL,以K2CrO4溶液为指示剂,用c mol/LAgNO3 标准溶液滴定至终点,消耗标准溶液的体积为b mL。(已知:Ag2CrO4为砖红色固体)
①亚硝酰氯(NOCl)的质量分数为_________(用代数式表示即可)。
②若滴定前,滴定管尖嘴有气泡,滴定后气泡消失,则所测亚硝酰氯的纯度_________(偏高、偏低、无影响)
【题目】以煤为原料可合成一系列燃料。
(1)已知:①2H2(g)+O2(g)=2H2O(g) ΔH=-483.6 kJ/mol,
②CH3OH(g)+H2O(g)=CO2(g)+3H2(g) ΔH=+49.0 kJ/mol
请写出甲醇燃烧生成H2O(g)的热化学方程式_________;
(2)向1 L密闭容器中加入2 mol CO、4 mol H2,在适当的催化剂作用下,发生反应:2CO(g)+4H2(g)CH3OCH3(l)+H2O(l) ΔH=+71 kJ/mol
①该反应能否_________自发进行(填“能”、“不能”或“无法判断”)
②下列叙述能说明此反应达到平衡状态的是_________.
a.混合气体的平均相对分子质量保持不变 b.CO和H2的转化率相等
c.CO和H2的体积分数保持不变 d.混合气体的密度保持不变
e.1 mol CO生成的同时有1 mol O-H键断裂
(3)CO2(g)+3H2(g)CH3OH(g)+H2O(g) ΔH<0在一定条件下,某反应过程中部分数据如下表:
反应条件 | 反应时间 | CO2(mol) | H2(mol) | CH3OH(mol) | H2O(mol) |
恒温恒容 (T1℃、2L) | 0min | 2 | 6 | 0 | 0 |
10min | 4.5 | ||||
20min | 1 | ||||
30min | 1 |
①0~10 min内,用H2O(g)表示的化学反应速率v(H2O)=_________mol/(L·min);
span>②达到平衡时,该反应的平衡常数K=_________(用分数表示),平衡时H2的转化率是_________;
③在其他条件不变的情况下,若30 min时向容器中再充入1 mol CO2(g)和1 mol H2O(g),则平衡_______移动(填“正向”、“逆向”或“不”);
(4)用甲醚(CH3OCH3)作为燃料电池的原料,请写出在碱性介质中电池负极反应式_________。