题目内容
【题目】反应2NO2(g)![]() N2 O4(g);△H= -57 kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是
N2 O4(g);△H= -57 kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是
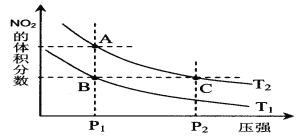
A.A、C两点的反应速率:A>C
B.A、C两点气体的颜色:A浅,C深
C.由状态A到状态B,可以用加热的方法
D.A、C两点气体的平均相对分子质量:A>C
【答案】B
【解析】
试题分析: 2NO2(g)![]() N2 O4(g);△H= -57 kJ·mol-1为放热反应,升高温度,化学平衡逆向移动,NO2的体积分数增大,
N2 O4(g);△H= -57 kJ·mol-1为放热反应,升高温度,化学平衡逆向移动,NO2的体积分数增大,![]() ;增大压强,化学平衡逆向移动,NO2的体积分数减小。由图象可知,A、C两点都在等温线上,C点的压强大,所以反应速率快,则A、C两点的反应速率:A<C,故A错误; A、C两点都在等温线上, C点压强大,所以NO2的浓度大,C点颜色深,故B正确;
;增大压强,化学平衡逆向移动,NO2的体积分数减小。由图象可知,A、C两点都在等温线上,C点的压强大,所以反应速率快,则A、C两点的反应速率:A<C,故A错误; A、C两点都在等温线上, C点压强大,所以NO2的浓度大,C点颜色深,故B正确;![]() ,由状态A到状态B,可以用降温的方法,故C错误;,C点的压强大于A点,增大压强平衡正向移动,气体物质的量减小,平均相对分子质量增大,平均相对分子质量A<C,故D错误。
,由状态A到状态B,可以用降温的方法,故C错误;,C点的压强大于A点,增大压强平衡正向移动,气体物质的量减小,平均相对分子质量增大,平均相对分子质量A<C,故D错误。

【题目】已知反应2CH3OH(g)![]() CH3OCH3(g)+H2O(g)某温度下的平衡常数为400。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
CH3OCH3(g)+H2O(g)某温度下的平衡常数为400。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
物质 | CH3OH | CH3OCH3 | H2O |
浓度/ (mol·L-1) | 0.44 | 0.6 | 0.6 |
(1)比较此时正.逆反应速率的大小:v正_______v逆(填“>”“<”或“=”)。
(2)若加入CH3OH后,经10 min反应达到平衡,此时c(CH3OH)=___________;该时间内反应速率v(CH3OH)=___________。
【题目】Ⅰ、实验室要配制物质的量浓度为0.1 mol/L的NaOH溶液480 mL
(1)填表:
配制时应称量NaOH的质量/g | 已给仪器 | 配制时除已给仪器外还需要的其他仪器 |
__________ | 烧杯、药匙、托盘天平 | ____________________________ |
(2)若要计算该溶液溶质的质量分数,还需要的一个条件是______________(用文字说明)。
(3)下列操作对配制的NaOH溶液浓度有偏高影响的是_________________(填字母)
A.称量NaOH固体时,露置在空气的时间过长
B.选用的容量瓶内有少量的蒸馏水
C.在烧杯中溶解NaOH后,立即将所得溶液注入容量瓶中
D.在定容时仰视容量瓶刻度线
Ⅱ、实验室用下图几个实验装置,可快速制取少量气体,并进行相关性质实验。
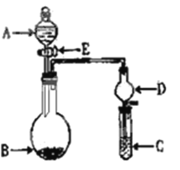
(1)若 A为30%H2O2溶液,B为MnO2 ,C盛有氢硫酸(H2S)饱和溶液,旋开E后,C中出现浅黄色浑浊的现象,写出C中发生反应的化学方程式:______________________________________。
(2)若A中装有浓盐酸,B中装有固体KMnO4 ,C中盛有KI淀粉溶液,旋开E后,B中出现黄绿色气体。已知1 mol KMnO4发生反应时转移5mol电子。则B中发生反应的离子方程式是:_______;C中的现象是:___________。