【题目】已知反应A(g)+B(g) ![]() C(g)+D(g)的平衡常数K值与温度的关系如表所示,830 ℃时,向一个2 L的密闭容器中充入0.20 mol A和0.20 mol B,10 s时达平衡。下列说法不正确的是
C(g)+D(g)的平衡常数K值与温度的关系如表所示,830 ℃时,向一个2 L的密闭容器中充入0.20 mol A和0.20 mol B,10 s时达平衡。下列说法不正确的是
温度/℃ | 700 | 830 | 1200 |
K值 | 1.7 | 1.0 | 0.4 |
A. 达到平衡后,B的转化率为50%
B. 增大压强,正、逆反应速率均加快
C. 该反应为吸热反应,升高温度,平衡正向移动
D. 反应初始至平衡,A的平均反应速率v(A)=0.005 mol·L-1·s-1
【题目】废旧锂离子电池的正极材料试样(主要含有LiCoO2及少量Al、Fe等)可通过下列实验方法回收钴,并制备金属锂。
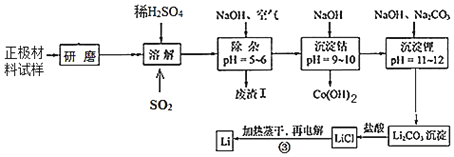
已知:①部分金属氢氧化物开始沉淀和完全沉淀时的pH:
氢氧化物 | Fe(OH)3 | Al(OH)3 | Co(OH)2 |
开始沉淀pH | 2.7 | 3.7 | 9.6 |
完全沉淀pH | 3.7 | 4.7 | 11 |
②Li2CO3在不同温度下的溶解度如下表:
温度/℃ | 0 | 10 | 20 | 50 | 75 | 100 |
Li2CO3的溶解度/g | 1.539 | 1.406 | 1.329 | 1.181 | 0.866 | 0.728 |
(1)LiCoO2中,Co元素的化合价为_____。
(2)上述流程中为加快化学反应速率而采取的措施是_____。
(3)在上述溶解过程中,通入SO2的目的为_____。
(4)加NaOH调pH的目的是_____。
(5)写出“沉钴”过程中发生反应的离子方程式_____。
(6)洗涤所得Li2CO3沉淀要使用_____(填“热水”或“冷水”),将氯化锂溶液蒸干的过程中还需不断通入HCl气体,其作用是_____。
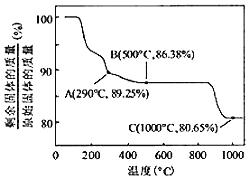
(7)Co(OH)2在空气中加热时,固体残留率随温度的变化如图所示。已知钴的氢氧化物加热至290℃时已完全脱水,则1000℃时,剩余固体的成分为_____(填化学式)。