题目内容
【题目】关于下列转化过程分析不正确的是

A.Fe3O4 中 Fe 元素的化合价为+2、+3
B.过程Ⅰ中每消耗 58 g Fe3O4 转移 1 mol 电子
C.过程Ⅱ的化学方程式为 3FeO+H2O![]() Fe3O4+H2↑
Fe3O4+H2↑
D.该过程总反应为 2H2O═2H2↑+O2↑
【答案】B
【解析】
A.Fe3O4的化学式可以改写为Fe2O3FeO,Fe3O4中Fe元素的化合价为+2、+3,故A正确;
B.过程Ⅰ:2Fe3O4(s)=6FeO(s)+O2(g)当有2molFe3O4分解时,生成1mol氧气,而58g Fe3O4的物质的量为0.25mol,故生成0.125mol氧气,而氧元素由-2价变为0价,故转移0.5mol电子,故B错误;
C.过程Ⅱ中FeO与水反应生成四氧化三铁和氢气,反应化学方程式为3FeO+H2O![]() Fe3O4+H2↑,故C正确;
Fe3O4+H2↑,故C正确;
D.过程Ⅰ:2Fe3O4(s)==6FeO(s)+O2(g)过程II:3FeO(s)+H2O(l)==H2(g)+Fe3O4(s),相加可得该过程总反应为2H2O==O2↑+2H2↑,故D正确;
故选:B。

【题目】化学与社会、生活密切相关,对下列现象或事实的解释正确的是( )
选项 | 现象或事实 | 解释 |
A |
| Cu从 |
B | 节日燃放的五彩缤纷的烟花 | 碱金属以及锶、钡等金属化合物的焰色反应 |
C | 铝箔在酒精灯火焰上加热熔化但不滴落 | 氧化铝的熔点低于铝的熔点 |
D | 氢氟酸可用于蚀刻玻璃 |
|
A.AB.BC.CD.D
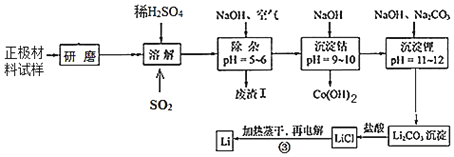
【题目】废旧锂离子电池的正极材料试样(主要含有LiCoO2及少量Al、Fe等)可通过下列实验方法回收钴,并制备金属锂。
已知:①部分金属氢氧化物开始沉淀和完全沉淀时的pH:
氢氧化物 | Fe(OH)3 | Al(OH)3 | Co(OH)2 |
开始沉淀pH | 2.7 | 3.7 | 9.6 |
完全沉淀pH | 3.7 | 4.7 | 11 |
②Li2CO3在不同温度下的溶解度如下表:
温度/℃ | 0 | 10 | 20 | 50 | 75 | 100 |
Li2CO3的溶解度/g | 1.539 | 1.406 | 1.329 | 1.181 | 0.866 | 0.728 |
(1)LiCoO2中,Co元素的化合价为_____。
(2)上述流程中为加快化学反应速率而采取的措施是_____。
(3)在上述溶解过程中,通入SO2的目的为_____。
(4)加NaOH调pH的目的是_____。
(5)写出“沉钴”过程中发生反应的离子方程式_____。
(6)洗涤所得Li2CO3沉淀要使用_____(填“热水”或“冷水”),将氯化锂溶液蒸干的过程中还需不断通入HCl气体,其作用是_____。
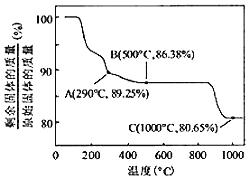
(7)Co(OH)2在空气中加热时,固体残留率随温度的变化如图所示。已知钴的氢氧化物加热至290℃时已完全脱水,则1000℃时,剩余固体的成分为_____(填化学式)。