��Ŀ����
����Ŀ���Ҷ���(HOOC-COOH)�׳Ʋ��ᡣ���ᾧ��Ļ�ѧʽΪH2C2O4��2H2O��������100��ʱ��ʼ������157��ʱ��������������ʼ�ֽ����CO��CO2��H2O�����������ڵ����¿�����Ϊ���壻������һ�ֶ�Ԫ���ᵫ���Ա�̼��ǿ�����л�ԭ����ʹ���Ը��������Һ��ɫ�������������ˮ���ش��������⣺
��1��д�����ᾧ�����ȷֽ�Ļ�ѧ����ʽ___��
��2����������װ�D��֤���ᾧ��ķֽ����(���ᾧ��ֽ�װ�á��д�װ�ü����ӵ��ܾ���ȥ)��
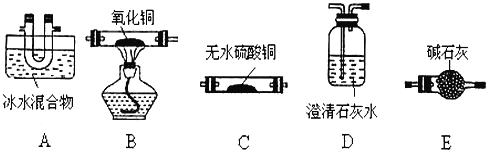
��װ�õ�����˳��Ϊ��___��___DEDE___��___��
��Aװ�õ�������___�������������CO��ʵ��������___��
��д������װ�ô��ڲ�����֮��___��
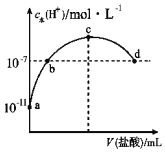
��3������������˵��������������Ե���___��
a.�����ᾧ�����ں���̪��NaOH��Һ�У���Һ��ɫ
b.�ⶨ������(Na2C2O4)��Һ��pH
c.�������Ũ�ȵIJ�����Һ��ϡ���ᣬϡ�������ļ������ǿ
d.pH=2�IJ�����Һ��ϡ���ᣬ�ֱ�ϡ��100����ǰ��pHС
e.�����ᾧ�����Na2CO3��Һ�У���CO2�ų�
��4����֪��NH3��H2ONH4++OH-��Kb=1.85��10-5
H2C2O4H++HC2O4-��Ka1=5.4��10-2
HC2O4-H++C2O42-��Ka2=5.4��10-5
��(NH4)2C2O4��Һ��pH___7(����>������<������=��)��
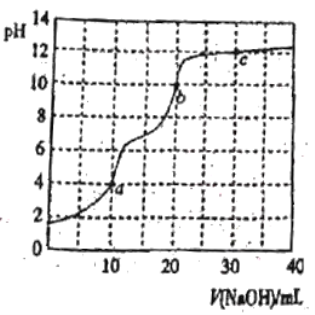
��5������0.10mol/L����KMnO4����Һ���ζ�δ֪Ũ�ȵIJ�����Һ��
��ȷ�������з������ɵ����ӷ���ʽΪ___��
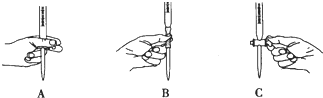
�ڵζ������в����ζ��ܵ�ͼʾ��ȷ����___��
��ÿ��ȷ��ȡ25.00mL������Һ���ζ����ηֱ�����0.10mol/L����KMnO4����Һ�������20.00mL��19.80mL��20.20mL����ò�����Һ�����ʵ���Ũ��Ϊ___��
���𰸡�H2C2O4��2H2O![]() CO��+CO2��+3H2O A C B D ��ȥ��������еIJ������� B�еĹ����ɺ�ɫ��Ϊ�Ϻ�ɫ��B��Dװ���еij���ʯ��ˮ����� ��CO��β������װ�� bd < 2MnO4-+5H2C2O4+6H+=2Mn2++10CO2��+8H2O A 0.20mol/L
CO��+CO2��+3H2O A C B D ��ȥ��������еIJ������� B�еĹ����ɺ�ɫ��Ϊ�Ϻ�ɫ��B��Dװ���еij���ʯ��ˮ����� ��CO��β������װ�� bd < 2MnO4-+5H2C2O4+6H+=2Mn2++10CO2��+8H2O A 0.20mol/L
��������
��1������ֽ����CO��![]() ��
��![]() ����Ӧ����ʽΪ��
����Ӧ����ʽΪ��
H2C2O4��2H2O![]() CO��+CO2��+3H2O�� �ʴ�Ϊ��H2C2O4��2H2O
CO��+CO2��+3H2O�� �ʴ�Ϊ��H2C2O4��2H2O![]() CO��+CO2��+3H2O��
CO��+CO2��+3H2O��
��2���ٷֽ����ΪCO��![]() ��
��![]() ������ʱӦ��������ˮ����ͭ����ˮ������Ȼ���ó���ʯ��ˮ���������̼������ü��ȵ�CuO�ͳ���ʯ��ˮ����CO�����ڲ�����100��ʱ��ʼ������157��ʱ�������������������ڵ����¿�����Ϊ���壬����Ҳ��ʹ����ʯ��ˮ����ǣ��ʼ���CO2֮ǰ�����ȥ��������������CO֮ǰ������ȫ��ȥCO2����������������˳��Ϊ��ACDEDBD�� �ʴ�Ϊ��A C B D��
������ʱӦ��������ˮ����ͭ����ˮ������Ȼ���ó���ʯ��ˮ���������̼������ü��ȵ�CuO�ͳ���ʯ��ˮ����CO�����ڲ�����100��ʱ��ʼ������157��ʱ�������������������ڵ����¿�����Ϊ���壬����Ҳ��ʹ����ʯ��ˮ����ǣ��ʼ���CO2֮ǰ�����ȥ��������������CO֮ǰ������ȫ��ȥCO2����������������˳��Ϊ��ACDEDBD�� �ʴ�Ϊ��A C B D��
�ڲ���������ʹ����ʯ��ˮ����ǣ�Aװ�õ������dz�ȥ��������еIJ�����������װ��B�к�ɫ�����ɺ�ɫ����B��װ��D�г���ʯ��ˮ����ǣ���֤����������к���CO���ʴ�Ϊ����ȥ��������еIJ���������B�еĹ����ɺ�ɫ��Ϊ�Ϻ�ɫ��B��Dװ���еij���ʯ��ˮ����ǣ�
��һ����̼�ж���Ⱦ��������Ҫ����β��������һ����̼β���Ĵ�������Ϊ��ȼ���������ռ����ʴ�Ϊ����CO��β������װ�ã�
��3��![]() �����ᾧ�����ں���̪��NaOH��Һ�У���Һ��ɫ��ֻ��˵����Ӧ������˵�����������ᣬ��a����
�����ᾧ�����ں���̪��NaOH��Һ�У���Һ��ɫ��ֻ��˵����Ӧ������˵�����������ᣬ��a����
![]() �ⶨ������
�ⶨ������![]() ��Һ��pH�����Լ��ԣ�֤�����������ˮ�⣬֤�����������ᣬ��b��ȷ��
��Һ��pH�����Լ��ԣ�֤�����������ˮ�⣬֤�����������ᣬ��b��ȷ��
![]() �������Ũ�ȵIJ�����Һ��ϡ���ᣬ��������ᶼΪ��Ԫ�ᣬ���ļ��������ȣ���c����
�������Ũ�ȵIJ�����Һ��ϡ���ᣬ��������ᶼΪ��Ԫ�ᣬ���ļ��������ȣ���c����
![]() pH=2�IJ�����Һ��ϡ���ᣬ�ֱ�ϡ��100����ǰ��pHС��˵����ˮϡ�ʹٽ�������룬֤��������Һ�д��ڵ���ƽ�⣬����Ϊ���ᣬ��d��ȷ��
pH=2�IJ�����Һ��ϡ���ᣬ�ֱ�ϡ��100����ǰ��pHС��˵����ˮϡ�ʹٽ�������룬֤��������Һ�д��ڵ���ƽ�⣬����Ϊ���ᣬ��d��ȷ��
![]() ��������Һ����
��������Һ����![]() ��Һ�У���
��Һ�У���![]() �ų���ֻ��˵���������Դ���̼�ᣬ������֤�����������ᣬ��e����
�ų���ֻ��˵���������Դ���̼�ᣬ������֤�����������ᣬ��e����
�ʴ�Ϊ��bd��
��4�������ݿ�֪��Ka1>Ka2>Kb������Խ��Խˮ�⣬![]() ��NH4+ˮ��̶ȸ�����Һ�����ԣ�
��NH4+ˮ��̶ȸ�����Һ�����ԣ�![]() ���ʴ�Ϊ��
���ʴ�Ϊ��![]() ��
��
��5���ٸ�����ؾ���ǿ�����ԣ��Ѳ����е�C��![]() ��������
��������![]() �۵Ķ�����̼��MnԪ�ش�
�۵Ķ�����̼��MnԪ�ش�![]() �۱仯��
�۱仯��![]() �۵������ӣ����ڲ����������2��Cԭ�ӣ����Ը�����������ķ�Ӧ����Ϊ5��2���ʷ�Ӧ�����ӷ���ʽΪ��
�۵������ӣ����ڲ����������2��Cԭ�ӣ����Ը�����������ķ�Ӧ����Ϊ5��2���ʷ�Ӧ�����ӷ���ʽΪ��![]() ���ʴ�Ϊ��
���ʴ�Ϊ��![]() ��
��
��KMnO4��Һ����ǿ�����ԣ�Ӧ����ʽ�ζ���ʢ�ţ����ݵζ��ܵ�ʹ�ù��ζ�ʱ�����ֿ�����ʽ�ζ��ܵĻ�������ֹ���������������ͼA��ʾ�������ʴ�Ϊ��A��
�۵ζ����ηֱ����ĵ�![]() ��Һ�������
��Һ�������![]() ��
��![]() ��
��![]() �����ĵ�
�����ĵ�![]() ��Һ�����ƽ��Ϊ��
��Һ�����ƽ��Ϊ��![]() ��
��
![]() �������
�������![]() ����
����
![]()
2mol 5mol
![]()
���![]() ��
��
�ʴ�Ϊ��![]() ��
��

����Ŀ��̼�������(![]() )������Ϊ��ɫ�峺Һ�塣��Ҫ����������ά�ء���֬��һЩҩ����ܼ������л��ϳɵ��м��塣��������װ���Ʊ�̼���������
)������Ϊ��ɫ�峺Һ�塣��Ҫ����������ά�ء���֬��һЩҩ����ܼ������л��ϳɵ��м��塣��������װ���Ʊ�̼���������
��ѧʽ | �۵�/�� | �е�/�� | �������� |
COCl2 | -118 | 8.2 | ����ˮ�����ڷ������������Ȼ�̼���ȷ¡�����ȶ����л��ܼ�����ˮѸ��ˮ�⣬�����Ȼ��� |
SO3 | 16.8 | 44.8 | ����ˮ������ˮ��Ӧ��������ͷų��������� |
SO2Cl2 | -54.1 | 69.1 | �������ᡢ������ˮ��Ӧ����H2SO4��HCl |
CCl4 | -22.9 | 76.8 | ����ˮ�������ڶ����л��ܼ� |
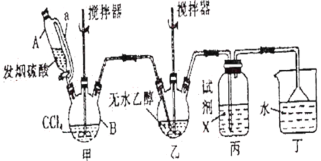
�ش��������⣺
(1)��װ����Ҫ�����Ʊ�����(COCl2)���Ƚ�����B�е����Ȼ�̼������55��60�����ٻ����μӷ������ᡣ
������B��������__________��
������A�IJർ��a��������__________��
(2)�Լ�X��__________����������__________��
(3)��װ�ó�������COCl2�⣬�������յ�������__________(�ѧʽ)������B�����Ȼ�̼�뷢������(��SO3��ʾ)��Ӧֻ�����������ʵ���Ϊ1��1�IJ���Ҿ�����ˮ��Ӧ��д���÷�Ӧ��ѧ����ʽ��__________��
(4)��ˮ�Ҵ��������Ӧ�����ȼ����������ټ������Ҵ���Ӧ����̼���������
��д����ˮ�Ҵ��������Ӧ�����ȼ��������Ļ�ѧ����ʽ��__________��
������ʼͶ��92.0g��ˮ�Ҵ������յõ�̼�������94.4g����̼��������IJ�����__________(��λ��Ч����)
����Ŀ���±���Ԫ�����ڱ���һ���֣��������е���ĸ�ֱ����һ��Ԫ�ء�
A | |||||||||||||||||
B | C | D | E | F | T | ||||||||||||
G | H | I | J | K | L | ||||||||||||
M | N | O | |||||||||||||||
�Իش��������⣨ע�⣺ÿ���е���ĸ����Ϊ�ϱ��е���ĸ���ţ�����ΪԪ�ط��ţ�
(1)N�ĵ��ʺ�ˮ������Ӧ�����ɹ���X����I�ĵ�����X��Ӧ�Ļ�ѧ����ʽ_______��
(2)D����̬�⻯���VSEPRģ�͵�����Ϊ_______��
(3)��A��C��D�γɵ�ACD�����У�����������������= _______________��
(4)Ҫ֤��̫�����Ƿ���R Ԫ�أ��ɲ��õķ�����__________________________��
(5)Ԫ��M�Ļ�����(ME2L2)���л��ϳ��п������������Ȼ��������������л��ﷴӦ���ش����⣺
��ME2L2������Ϊ���ɫҺ�壬����CCl4��CS2�Ȼ��ܣ��ݴ˿��ж�ME2L2��_________������ԡ��Ǽ��ԡ������ӡ�
�ڽ�N��O�ĵ����õ������Ӻ����D������������Ӧ��ˮ����Ũ��Һ�У����Ƴ�ԭ��أ�����ɸ������ϵ�Ԫ�ص���Χ���ӹ����ʾʽΪ______________________��
(6)��O2����Һ�м��백ˮ���γ���ɫ�������������백ˮ���������ܽ�����ɫ����Һ��д�������ܽ�����ӷ���ʽ_____��
(7)��F ��K����Ԫ���γɵĻ�����������ԭ�ӵļ۵���ȫ������ɼ�����û�����Ŀռ乹�͵�����Ϊ___��
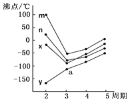
(8)��ͼ�������߷ֱ��ʾ��A�塢��A�塢��A�塢��A��Ԫ����̬�⻯��е�仯����E���⻯�����ڵ�������__����m��n��x��y����
(9)1183 K���´�N����Ļ����ṹ��Ԫ��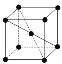 ��ʾ��1183 K����ת��Ϊ
��ʾ��1183 K����ת��Ϊ ��ʾ�ṹ�Ļ����ṹ��Ԫ����1183 K���µľ����У��ռ�������Ϊ____����1183 K���ϵľ����У���Nԭ�ӵȾ����������Nԭ����Ϊ____������ѻ���ʽ������Ϊ_____��
��ʾ�ṹ�Ļ����ṹ��Ԫ����1183 K���µľ����У��ռ�������Ϊ____����1183 K���ϵľ����У���Nԭ�ӵȾ����������Nԭ����Ϊ____������ѻ���ʽ������Ϊ_____��