【题目】中和滴定是高中化学重要的定量实验。请回答下列问题:
(1)用标准盐酸滴定未知浓度的NaOH溶液,下列情况会造成测定结果偏高的是________(填选项字母)。
A.滴定终点读数时,俯视滴定管刻度
B.盛装NaOH溶液的锥形瓶用蒸馏水洗过,未用NaOH溶液润洗
C.酸式滴定管用蒸馏水洗净后,未用标准盐酸润洗
D.滴定前,滴定管尖嘴有气泡,滴定后气泡消失
(2)取草酸溶液置于锥形瓶中,加入适量稀硫酸,用浓度为0.02 mol·L-1的高锰酸钾溶液滴定,发生反应的离子方程式为:_________________
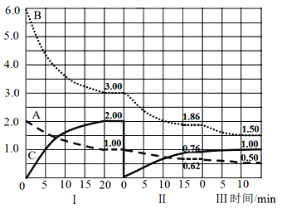
(3)滴定数据如下:
滴定次数 | 待测液体积(mL) | 标准KMnO4溶液体积(mL) | |
滴定前读数 | 滴定后读数 | ||
第一次 | 25.00 | 0.50 | 20.40 |
第二次 | 25.00 | 3.00 | 23.40 |
第三次 | 25.00 | 4.00 | 24.10 |
①滴定时,该反应速率开始十分缓慢,一段时间后突然加快,这是因为_________(填离子)对该反应具有催化作用,KMnO4溶液应装在_____(填“酸”或“碱”)式滴定管中;滴定终点的现象是_____________________。
②该草酸溶液的物质的量浓度为____________。
【题目】今有室温下四种溶液,有关叙述不正确的是( )
① | ② | ③ | ④ | |
浓度c/mol/L | 0.1 | 0.1 | 0.1 | 0.1 |
溶液 | 氨水 | CH3COONa溶液 | 醋酸 | 盐酸 |
A.在20 mL ①溶液中逐滴加入③溶液,溶液导电能力变化如下图

B.②、③两溶液等体积混合,离子浓度:2c(Na+)=c(CH3COO-)+c(CH3COOH)
C.①、④两溶液等体积混合,离子浓度:c(Cl-)>c(NH4+)>c(H+)>c(OH-)
D.用④滴定①,滴定曲线如下图,可用酚酞作指示剂