题目内容
【题目】25℃时,起始浓度为0.1mol.L-1的亚硫酸溶液中,H2SO3、HSO3-、SO32-三种微粒的物质的量分数(即微粒本身物质的量与三种粒子总物质的量之比)随pH变化的关系如图所示。下列说法正确的是
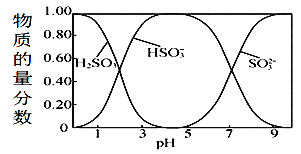
A.读取图中数据计算可得到常温下亚硫酸溶液的Ka2≈10-7
B.向该体系中加入一定量的NaOH固体,HSO3-的物质的量分数一定增大
C.在pH=1.0溶液中:c(H2SO3)>c(HSO3-)>c(H+)>c(OH-)
D.在该体系中的任意一点都存在:c2(H+)=c(H+)·c(HSO3-)+2c(H+)c(SO32-)+Kw
【答案】A
【解析】
A.H2SO3是二元弱酸,在溶液中电离是分步进行的,亚硫酸的第二步电离方程式为:HSO3-H++SO32-,根据图象可知,pH=7时,亚硫酸根离子与亚硫酸氢根离子浓度相等,则Ka2=10-7,选项A正确;
B. 向该体系中加入一定量的NaOH固体,OH-与HSO3-反应生成SO32-和水,使HSO3-的物质的量分数降低,选项B错误;
C. 根据图中信息可知,在pH=1.0溶液中:c(H2SO3)>c(HSO3-),溶质为亚硫酸,为二元弱酸,分步电离,c(H+)> c(HSO3-),选项C错误;
D.根据图中信息可知,若溶质只有 H2SO3的溶液中,根据电荷守恒可得:c(H+)=c(HSO3-)+2c(SO32-)+c(OH-),将电苻守恒式两边都乘c(H+)可得:c2(H+)=c(H+)c(HSO3-)+2c(H+)c(SO32-)+c(H+)c(OH-),Kw=c(H+)c(OH-),所以c2(H+)=c(H+)c(HSO3-)+2c(H+)c(SO32-)+Kw,但若加入碱后,pH增大,则有其他阳离子,则c2(H+)<c(H+)c(HSO3-)+2c(H+)c(SO32-)+Kw,选项D错误;
答案选A。

 名校课堂系列答案
名校课堂系列答案